pH de solutions aqueuses
I. Les différents types de solutions acido-basiques
Rappels
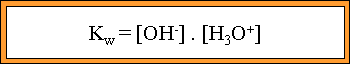

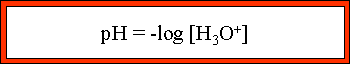
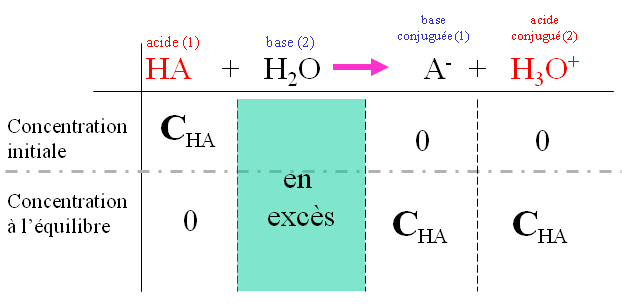
II. Acide fort : Un acide fort est totalement dissocié
pH = - log [H3O+] --> ![]() ; CHa, étant la
concentration initiale d'acide exprimée
en mol.L-1 ou molaire.
; CHa, étant la
concentration initiale d'acide exprimée
en mol.L-1 ou molaire.
III. Base forte : Une base forte est totalement dissociée
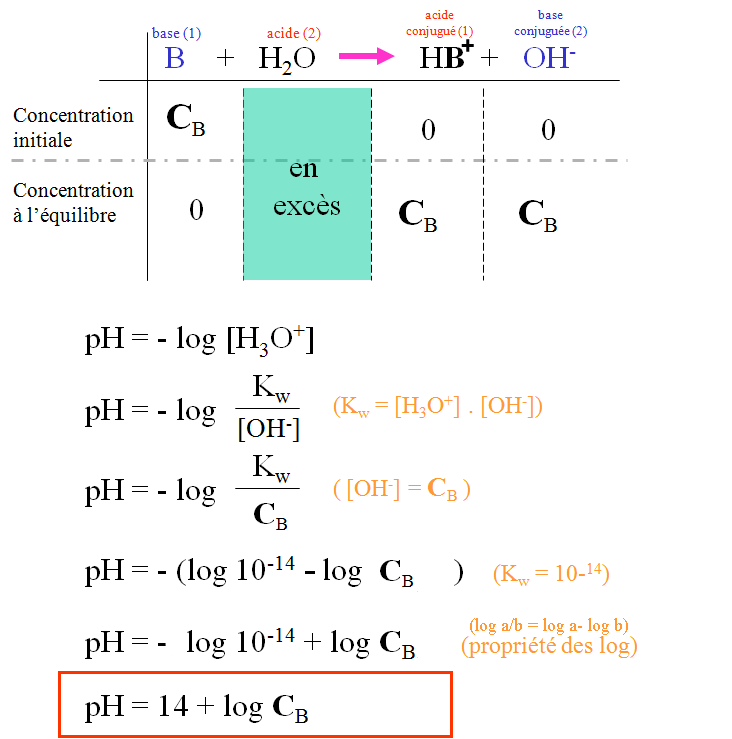
IV. Acide faible : un acide faible est partiellement dissocié

V. Base faible : une base faible placée en solution aqueuse
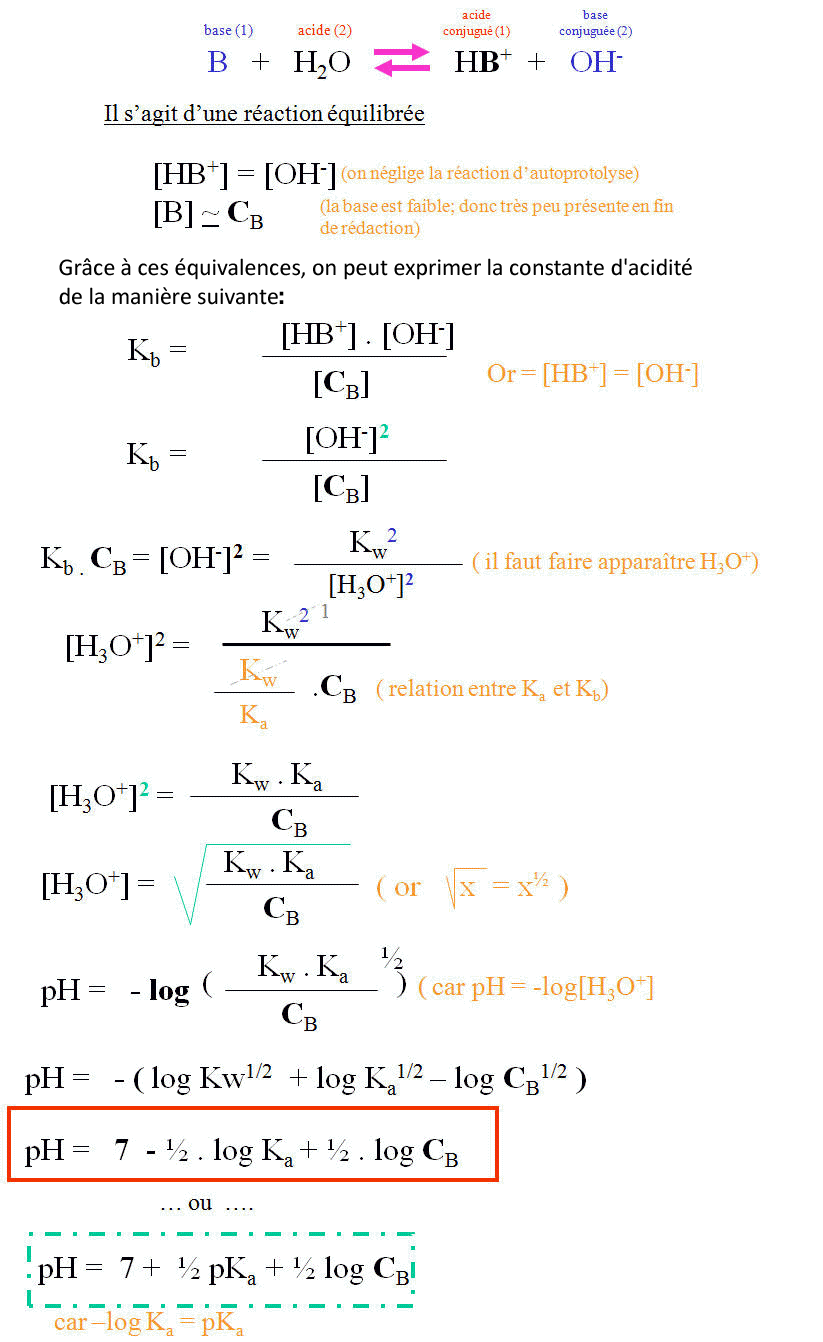
VI. Mélange Tampon : Solution d'un acide faible et de sa base conjuguée

![]() Si la
solution est composée d'une base faible et de son acide conjugué ou d'un acide
faible et de sa base conjuguée, on parlera de
mélange tampon. Ce mélange aura comme caractéristique de garder un pH très
stable. Ce type de solution est utilisé pour étalonner les pH-mètres.
Si la
solution est composée d'une base faible et de son acide conjugué ou d'un acide
faible et de sa base conjuguée, on parlera de
mélange tampon. Ce mélange aura comme caractéristique de garder un pH très
stable. Ce type de solution est utilisé pour étalonner les pH-mètres.
-
Un mélange tampon auquel j'additionne du chlorure d'hydrogène (HCl) ou de l'hydroxyde de sodium (NaOH) va garder un pH très stable. La variation de pH pour de petits ajouts sera très faible alors qu'un même ajout dans de l'eau distillée provoquerait des écarts de pH de plus de 4 unités (soit 10.000 fois plus !).
Composition d'un mélange tampon : Acide / base conjuguée
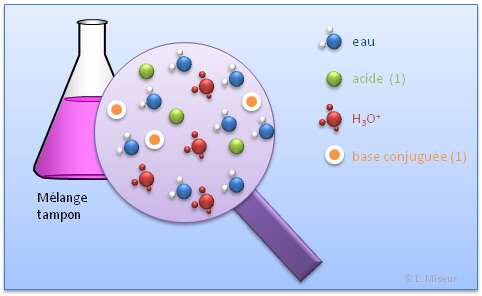
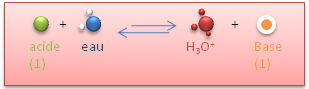
Dans un mélange tampon, l'on retrouve : l'eau, l'acide, sa base conjuguée et H3O+.
Ces différentes espèces sont en équilibres dans la solutions.
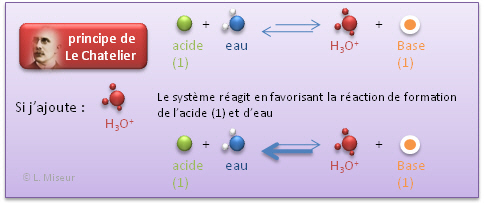
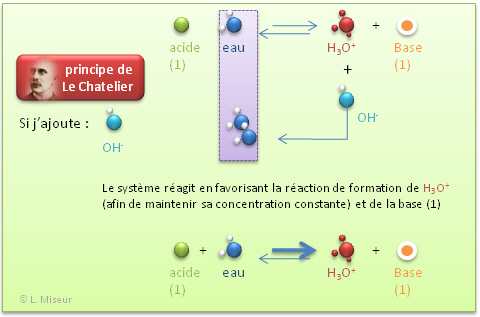
Que se passe-t-il lorsque je modifie l'équilibre?
- Par ajout d'un acide fort (HCl)
- Par ajout d'une base forte (NaOH)
Nous voyons donc que ces faibles variations de pH (qui sont donc de faibles variations de la concentration en ions H3O+) peuvent être expliquée sur base du principe de Le Chatelier.
Ces mélanges ont toutefois une limite ! Pour l'ajout de trop grande quantité de base ou d'acide, l'une des deux espèces du couple acide-base pourrait se retrouver totalement consommée et dans ce cas, la réaction deviendrait trop favorisée dans un sens et même complète.
Le pH d'une solution tampon composée de concentrations identiques en base et en acide vaut exactement la valeur du pKa (-log(Ka)) du couple.

Comment réaliser des mélanges tampon ?
Par l'ajout d'une même quantité de base et d'acide (du même couple !)
Par la neutralisation partielle de l'acide du couple par une base forte (la neutralisation par une base forte fera apparaitre la base conjuguée de l'acide)
Par la neutralisation partielle de la base du couple par un acide fort (la neutralisation par un acide fort de la base conjuguée du couple fera apparaitre l'acide)
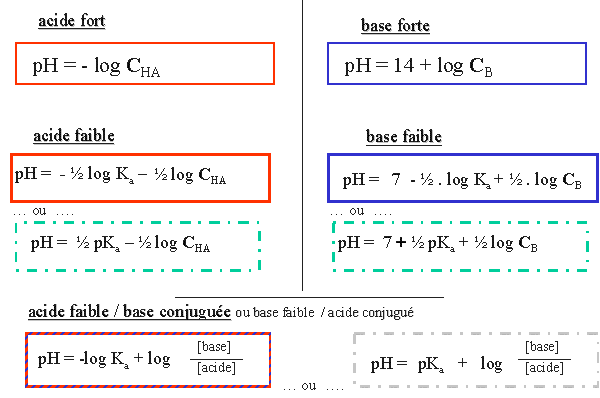
VII. Synthèse des formules de calcul de pH
VII.Exercices
![]()

- Relations pH, pOh, concentrations
- Association d'espèces conjuguées
- Equations acide-base à compléter
- Calcul de pH et concentrations
|
Copyright (c) 2000 - 2023 | Miseur Ludovic | www.lachimie.net | tous droits réservés | remis à jour le : 06/07/2023 |
|
|
|
Comment citer cette page : |
| Miseur, L. (2023). Lachimie.net - pH de solutions aqueuses. La Chimie.net. http://www.lachimie.net | |
|
|