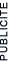Ionisation des atomes
I. Notion d'ion
Un atome électriquement neutre est un atome qui possède le même nombre d'électrons que de protons. Des charges ne peuvent apparaître que si le nombre de protons n'est plus égal au nombre d'électrons. <
Le nombre de protons, contenus dans le noyau ne peut être modifié au cours d'un phénomène chimique non-nucléaire. C'est donc par conséquent les électrons qui jouent un grand rôle dans l'ionisation des atomes. Certains atomes ou groupements peuvent gagner ou perdre des électrons dans certaines situations.
I.1. Définition: ion
substance chargée d'électricité car les charges positives et négatives ne se compensent plus complètement. Le noyau d'un ion simple est identique à celui de l'atome correspondant ; seul le nuage électronique est différent (le nombre d'électrons est différent).
II. Ion positif ou cation
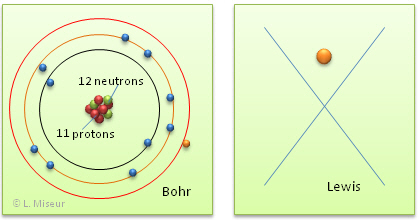
Représentons l'atome de sodium (Na) selon les modèles de Bohr et de Lewis :
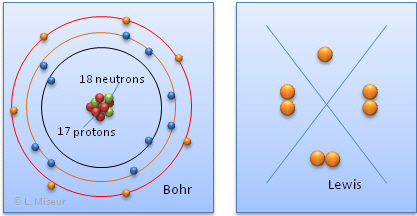
Tentons maintenant de représenter l'ion Na+, selon les mêmes modèles que précédemment.
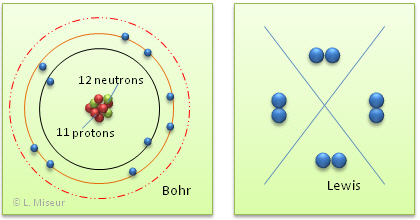
L'ion Na+ a perdu son seul électron de valence, il possède maintenant une couche externe complète, il a la configuration d'un gaz rare (règle de l'octet). On peut représenter ce phénomène sous forme d'une équation :o:p>
Na ---> Na+ +
1 e-
De manière générale, les
atomes ou groupements métalliques ont tendance à perdre leur(s) électron(s)
pour atteindre la configuration d'un gaz rare.
atome --> ion positif + électron(s)
III. Ion négatif ou anion
III.1. Définition
C'est un atome qui est chargé négativement car son nombre de protons est inférieur à son nombre d'électrons.
exemple : l'ion
Cl- :
|
forme neutre (Cl) |
|
|
|
ion Cl- |
|
|
Voici l'équation d'ionisation : Cl + 1e- --> Cl-
Forme générale :
atome + électron(s) --> ion négatif
Note : L'équation d'ionisation d'un atome est TOUJOURS le nombre d'électrons à enlever ou à ajouter pour qu'il obtienne la configuration d'un gaz rare !
Remarque :
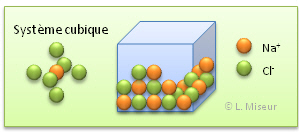
Des ions peuvent s'associer afin de former des solides. Ces solides sont alors composés d'ions positifs et négatifs qui s'attirent et se repoussent et ce jeu d'attraction-répulsion conduit à un arrangement particulier des ions en structures solides ordonnées.
exemple : Le cas du Chlorure de sodium (NaCl)
Compléter les équations d'ionisation des atomes suivants : Ca ---> Cu (I) ---> I ---> Ne --->
Déterminer le nombre de protons, de neutrons et d'électrons de chacun de ces ions :
ion Z (nombre de protons)
e-
neutron(s) ?
Mg ++ S2-

Réservé à une utilisation strictement privée-tous droits de reproduction et de diffusion réservés - (c) L. Miseur - La chimie.net 2012
|
Copyright (c) 2000 - 2023 | Miseur Ludovic | www.lachimie.net | tous droits réservés | remis à jour le : 06/07/2023 |
|
|
|
Comment citer cette page : |
| Miseur, L. (2023). Lachimie.net - Ionisation des atomes. La Chimie.net. http://www.lachimie.net | |
|
|