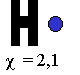Les liaisons chimiques
Les atomes s'assemblent en molécule en mettant en commun ou en cédant des électrons. Le but étant que la molécule soit plus stable que chaque atome isolé. Ainsi, dans certains cas, des électrons seront cédés d'un atome à un autre afin que chacun des deux atomes atteigne un état stable.
Dans certains cas, l'attraction réciproque entre des atomes, la liaison entre eux, se justifiera par le fait qu'ils sont chargés de signes contraires (+/-). Il peut y avoir des liaisons basées sur la simple attraction électrostatique (Forces de Coulomb) ou basée sur le partage d'électron de façon équitable ou pas entre les atomes.
I. Les différentes unions entre atomes ou "comment les atomes s'unissent-ils" ?
I.1. Liaison covalente normale parfaite ( CNP )
Exemple : la molécule d' H2 (dihydrogène) : chaque atome est constitué d'un proton (+) autour duquel gravite un électron (-). Il y a une force d'attraction qui s'exerce entre le proton et l'électron appartenant au
même atome. Ces mêmes éléments étant attirés également par ceux de l'atome voisin.
(!) Chaque atome d'hydrogène est électriquement neutre. Pourtant, ils sont composés de charges positives et négatives. Grâce à la présence des électrons, il est possible de combiner les charges afin de former une molécule électriquement neutre également (!)
Chacun des électrons est attiré par les deux noyaux, mais en même temps, des forces de répulsion s'exercent entre les éléments chargés identiquement (les noyaux se repoussent et les électrons se repoussent). Cela signifie que les deux atomes se rapprocheront jusqu'à une certaine distance. Cette distance étant le lieu où forces de répulsions et d'attractions sont égales. Il faut rappeler que les électrons et la liaison ne sont pas figés. Il s'agit d'un système dynamique (en mouvement). Ainsi, en moyenne, les électrons dans la molécule de dihydrogène ( H2 ) se trouvent entre les deux noyaux d'hydrogène.
Représentons la même chose mais avec le modèle de Lewis :
| soit :
|
Les deux électrons sont mis en
communs et perdent leur appartenance à l'un ou à l'autre atome. Ils sont
mis en communauté. Ces deux électrons forment une paire électronique. Dès
lors, chaque atome de H est entouré de deux électrons et a atteint la
configuration plus stable de L'Hélium.
Cette mise en commun est appelée liaison covalente ou covalence. |
||
| atome d'hydrogène | atome d'hydrogène |
Chaque élément va avoir tendance à essayer d'obtenir la configuration électronique du Gaz rare le plus proche.
Dans le cas ci-dessus, il s'agit d'une mise en commun entre atomes identiques. Cette mise en commun sera appelée Liaison covalente normale parfaite (CNP). La molécule étant parfaitement symétrique tant du point de vue des atomes que des électrons.
La représentation : Il s'agit de celle de Lewis légèrement modifiée. L'on représente d'abord chaque atome par son symbole entouré de ces signes (paires ou électrons), ensuite, on établit les paires entres les électrons des deux atomes. Exemple ci-dessous :
| H2 | soit : |
|
ce qui donne: |
|
I.2. Liaison covalente normale polarisée (CNpol.)
a. électronégativité
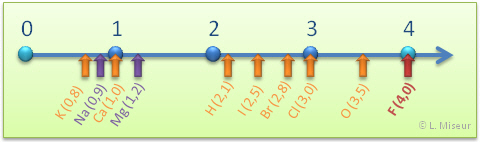
L'électronégativité d'un élément désigne la force d'attraction que cet élément exerce sur les électrons d'une liaison. L'élément le plus électronégatif est le Fluor (4) et le moins électronégatif est le Césium (0,7). L'électronégativité des autres éléments varie entre ces deux mesures. L'électronégativité augmente de gauche à droite dans une période et de bas en haut dans une même famille. L'électronégativité par le symbole c.
C'est le chimiste et physicien américain Linus Pauling qui a déterminé de façon arbitraire, (il a fait un choix), l'échelle d'électronégativité.
Il a attribué la valeur "4" au Fluor et par comparaison a attribué des valeurs aux autres éléments.

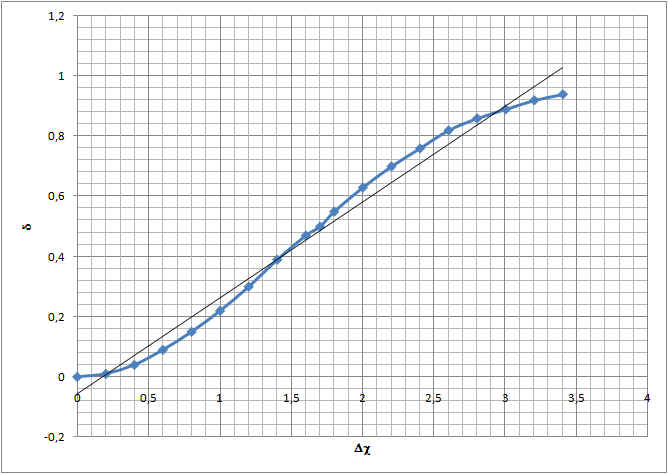
La différence d'électronégativité Δc entre deux éléments s'obtient en faisant la différence entre la plus grande valeur d'électronégativité et la plus basse.
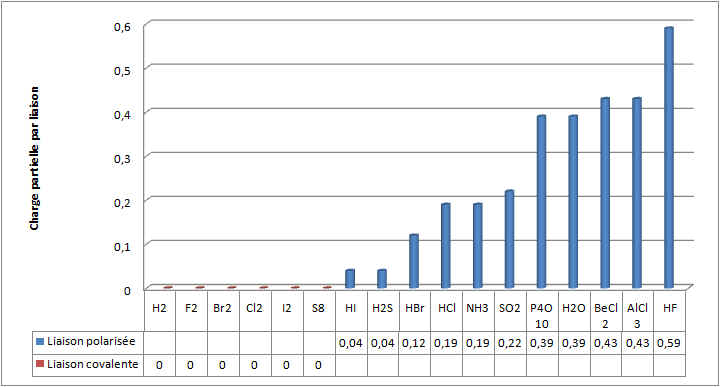
Les éléments dont la liaison est covalente normale polarisée ne portent pas des charges électriques entières. En effet, l'électron bien qu'étant plus attiré par l'un des atomes est toujours présent au côté de l'autre atome également. Ils mettent chacun en commun un électron célibataire. Cependant, si la différence d'électronégativité est inférieure ou égale à 1,5. Les électrons n'appartiendront pas à un élément spécifique. Ils seront juste plus souvent près de l'élément le plus électronégatif (en moyenne - n'oublions pas que c'est un modèle dynamique en mouvement au cours du temps !).
Chaque élément sera chargé avec une charge partielle. Observez le graphique ci-dessous faisant le lien entre la différence d'électronégativité et la charge partielle portée par les atomes.
|
|
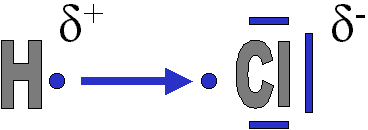
b. Démonstration avec la molécule d'HCl
1. Représentation des atomes sous forme du modèle de Lewis |
|
|
|
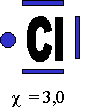 |
2. Calcul de la différence d'électronégativité des éléments |
|
| |
|
3. Représentation de la liaison en sachant que l'électron sera statistiquement plus souvent présent près de l'élément le plus électronégatif, celui-ci devenant donc partiellement négatif (1 électron en plus, la plupart du temps, mais pas tout le temps !), l'autre élément devenant partiellement positif (un électron en moins). La flèche indique qu'il s'agit d'un déplacement de l'électron et non du départ de l'électron. La flèche indique donc l'élément le plus électronégatif. |
|
|
|
|
|
|
|
Une liaison covalente normale polarisée est donc une mise en commun d'un ou plusieurs électrons célibataires entre atomes d'électronégativité peu différente (Δc ≤ 1,5). Au delà, l'électron va être attiré si fort par l'atome le plus électronégatif, qu'ils vont ou va lui être donné par l'autre atome !
Simulation : polarité des molécules
d. Quelques exemples avec des molécules courantes.
I.3. La Liaison ionique
Lorsque la différence d'électronégativité est supérieure à 2, les forces en présence s'exerçant sur les électrons de l'élément le moins électronégatif sont suffisantes pour lui arracher définitivement un ou plusieurs électrons. Il ne s'agit donc plus d'une mise en commun, mais d'un don.
Les charges seront donc complètes, l'élément le moins électronégatif perd un ou plusieurs électrons et devient donc un ion positif (cation) et l'élément le plus électronégatif reçoit un ou plusieurs électrons et devient donc un ion négatif (anion).
Les interactions entres ces éléments sont alors des interactions d'ordre électrostatique (Force de Coulomb).
Représentation avec une molécule de NaCl
|
1. Représentation sous forme du modèle de Lewis des éléments composant la molécule |
2. Calcul de la différence d'électronégativité |
3. La différence d'électronégativité est telle que l'élément le moins électronégatif cède un de ses électrons à l'élément le plus électronégatif. Le premier devient positif (+ 1 proton et le deuxième devient négatif ( + 1 électron). |
 |
Na (c = 0,9) et Cl (c = 3) | |
| -> (3 - 0,9) = 2,1 |
|
|
| -> Δc = 2,1 > 2 | ||
| -> ionique | ||
Définition
Une liaison ionique résulte d'une attraction entre ions formés par transfert d'électrons entre atomes d'électronégativités très différentes (Δc> 2) de l'atome le moins électronégatif vers l'atome le plus électronégatif.
![]() Pour les cas où la différence d'électronégativité est comprise entre 1,6 et 2, et, si aucune autre indication n'est ajoutée à l'énoncé, seul l'expérimentation pourra montrer s'il s'agit d'une liaison covalente normale polarisée ou d'une liaison ionique. Pour ces cas là, les deux réponses seront donc acceptées dans l'état actuel
de nos connaissances.
Pour les cas où la différence d'électronégativité est comprise entre 1,6 et 2, et, si aucune autre indication n'est ajoutée à l'énoncé, seul l'expérimentation pourra montrer s'il s'agit d'une liaison covalente normale polarisée ou d'une liaison ionique. Pour ces cas là, les deux réponses seront donc acceptées dans l'état actuel
de nos connaissances.
La liaison ionique n'est pas orientée. Il s'agit d'interactions électrostatiques entre des entités chargées de signes opposés. Voyons comme illustration la structure d'un cristal de sel de cuisine (NaCl). Il est impossible d'isoler une molécule "NaCl".
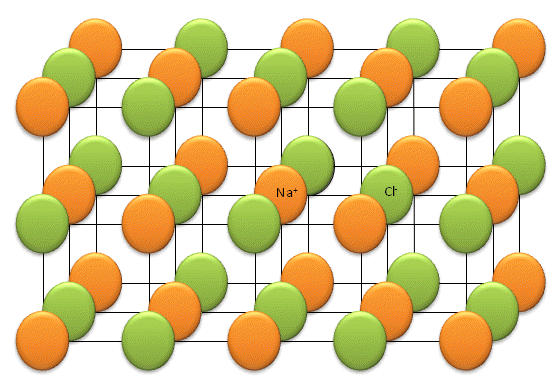
Un ion Na+ est attiré plusieurs ions Cl- et un ion Cl- est attiré par plusieurs ions Na+. Les ions Cl- se repoussent entre eux et les ions Na+ se repoussent entre eux. L'association des forces d'attractions et de répulsions permet d'arriver au résultat suivant : chaque cation est directement entouré d'anions et chaque anion est directement entouré de cations.
I.4. synthèse
Dans la molécule H2, l'attraction entre les deux noyaux est assurée par une paire d'électrons situés entre eux. Cette paire d'électrons est responsable de la liaison entre les deux noyaux.
Dans le cristal NaCl, la liaison est assurée par des interactions électrostatiques entre les ions et non plus par une paire d'électrons liants comme dans H2 , Cl2 ...
La liaison chimique peut revêtir deux aspects contrastés:
Une liaison assurée par la mise en commun d'une paire d'électrons liants: LIAISON COVALENTE si les électrons sont attirés par la même électronégativité par chacun des atomes, LIAISON COVALENTE POLARISEE, s'il existe une différence d'électronégativité inférieure ou égale à 1,5 entre les atomes.
Une liaison assurée par l'attraction électrostatique entre ions de signes opposés : LIAISON IONIQUE.
cas liaison
- entre deux éléments identiques (ex : H2)
liaison covalente normale parfaite
- différence d'électronégativité inférieure ou égale à 1,5 (Δc ≤ 1,5).
liaison covalente normale polarisée
- différence d'électronégativité supérieure à 2 (Δc > 2)
liaison ionique (*) Il existe cependant certaines exceptions à ces règles.
Lorsqu'il y a plus de deux éléments intervenant dans la molécule, il peut être difficile de représenter leur liaison (formule de structure). Avant de se lancer dans les exercices, quelques infos à savoir :
1. Les liaisons entre O sont à éviter, car peu stables. 2. Les liaisons entre O et H se forment très facilement 3. La liaison ionique est utilisée si un des atomes de la molécule ne réalise pas l'octet. Elle se rencontrera dans les molécules contenant un métal. 4. Les liaisons entre C (carbone) se font très facilement, ils peuvent être unis de façon simple, double voire triple. 5. Dans certains cas, la combinaison de deux types de liaison peut être possible. ( ex : liaison ionique et covalente dans la molécule de HNO2).

Copyright (c) 2000 - 2023 | Miseur Ludovic | www.lachimie.net | tous droits réservés | remis à jour le : 06/07/2023
Comment citer cette page : Miseur, L. (2023). Lachimie.net - Liaisons chimiques. La Chimie.net. http://www.lachimie.net