Thermochimie (1) - introduction
I. Définition de la thermochimie
Etude des changements de chaleur accompagnant les réactions chimiques. Cette chaleur est soit absorbée, soit dégagée.
II. Transfert de chaleur
Echange entre le milieu extérieur et le mélange en réaction.
-
Phénomène exothermique
- Définition : Phénomène produisant de l'énergie thermique (dégagement de chaleur)
| exemples : 1. | Ca + 2 H2O --> Ca(OH)2 + H2 + E |
| 2. | NaOH (s) |
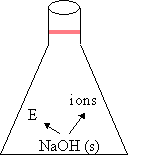
| NaOH (s) |
| Hr Hp |
- Enthalpie = contenu énergétique d'une substance, se note H.
Pour savoir si une réaction sera exothermique ou endothermique, il faut calculer la différence d'enthalpie. Celle-ci se calcule en faisant la différence entre l'enthalpie des produits (Hp) et l'enthalpie des réactifs (Hr). Si la différence d'enthalpie, notée : ΔH, est négative, la réaction sera exothermique. ΔH < 0.
Voici le diagramme d'enthalpie d'une réaction exothermique :
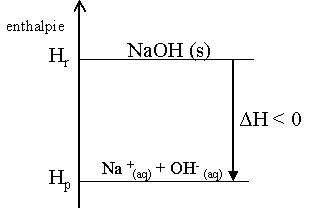
-
Phénomène endothermique
- Définition : Phénomène qui absorbe de l'énergie.
| exemple : 1. | KNO3 (s) + Énergie --> K+ (aq) + NO3 - (aq) |
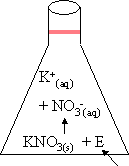 Une réaction est
endothermique, si la différence d'enthalpie entre les produits (Hp)
et les réactifs (Hr) est positive.
Une réaction est
endothermique, si la différence d'enthalpie entre les produits (Hp)
et les réactifs (Hr) est positive.
ΔH > 0
Diagramme enthalpie d'une réaction endothermique :
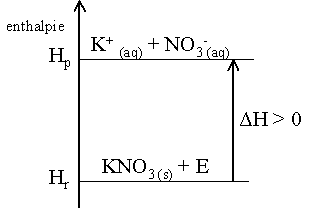
Remarque :
Chaleur et température sont des notions différentes souvent confondues !! La température ne dépend pas de la quantité de matière. A l'inverse, la chaleur dépend de la quantité de matière. La chaleur est une propriété extensive et la température est une propriété intensive (dont l'intensité ne change pas avec la quantité).
|
Copyright (c) 2000 - 2023 | Miseur Ludovic | www.lachimie.net | tous droits réservés | remis à jour le : 06/07/2023 |
|
|
|
Comment citer cette page : |
| Miseur, L. (2023). Lachimie.net - Thermochimie (1). La Chimie.net. http://www.lachimie.net | |
|
|


