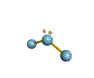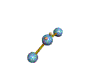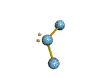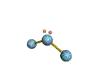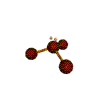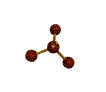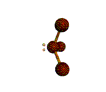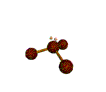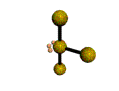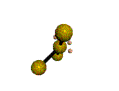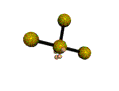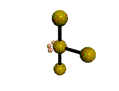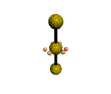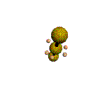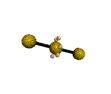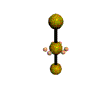Forme et géométrie des molécules
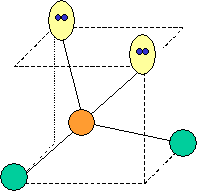
Négligée précédemment, intéressons-nous à la représentation spatiale des composés étudiés. La géométrie de ces composés autour de l'atome central dépend des doublets de liaisons (paires électroniques liantes) et des éventuelles paires libres (électrons seuls). L'atome central est celui qui est le plus électronégatif. La forme d'une molécule est la figure formée par ses atomes (figure observable).
Le modèle VSEPR
Valence Shell Électron Pair Repulsion Theory
Le principe : les paires électroniques liantes et libres se repoussent mutuellement. Par conséquent, elles se localisent dans l'espace de manière à minimiser leur répulsion.
Ce modèle permet d'expliquer la géométrie des paires électroniques autour d'un atome central. A une même géométrie, plusieurs formes de molécules pourront correspondre.
Laboratoire virtuel : découvrir la géométrie moléculaire
Règles et notations VSEPR
AXmEn ; où A est l'atome central de la molécule, X représente les paires liantes, E les paires libres et m,n représentent le nombre de paires de chaque type.
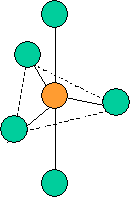
Règle n°1 : Il faut minimaliser la répulsion entre les paires électroniques (libres et liantes). Celles-ci se répartissent l'espace disponible (3D !).
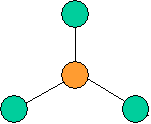
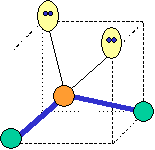
cas de 2 paires électroniques : AX2E0
2 paires opposées au maximum (180°) La molécule est linéaire et l'angle entre les deux paires est un angle plat (180°)
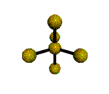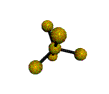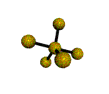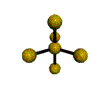
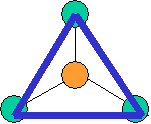
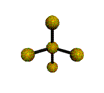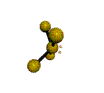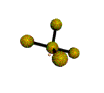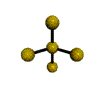
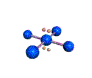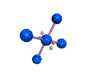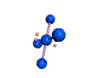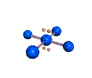
cas de 3 paires électroniques : AX3E0
*
*(c) Animated gif : Robyn Rindge '98 | www.chimmybear.com
3 paires situées dans le même plan et à égale distance les unes des autres : 120°, La molécule a la forme d'un triangle équilatéral
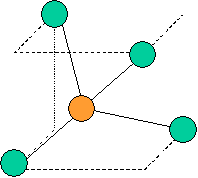
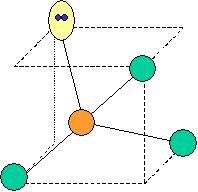
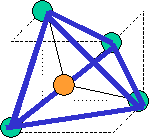
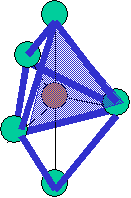
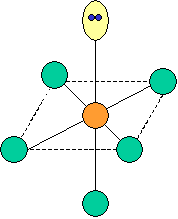
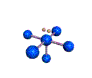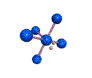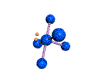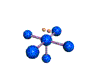
cas de 4 paires électroniques : AX4E0
4 paires liantes dirigées vers le centre d'un tétraèdre régulier et situées à 109° les unes des autres. La molécule est de forme tétraédrique.
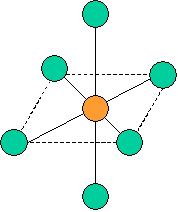
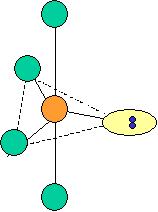
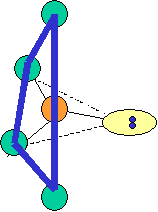
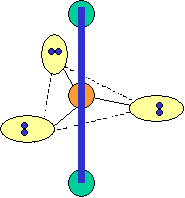
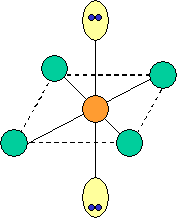
cas de 5 paires électroniques : AX5E0
5 paires. Les paires forment entre elles un angle de 120°
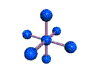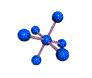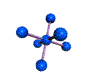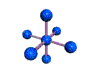
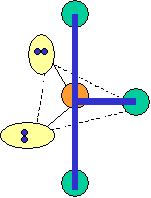
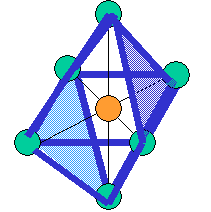
cas de 6 paires électroniques : AX6E0
6 paires. Les paires du plan équatorial forment entre elles un angle de 90°. Les paires axiales formant un angle de 120° avec les autres.
Règle n°2 : Les paires libres occupent plus de place que les paires liantes car la répulsion des paires libres est plus forte. Les angles entre les paires seront différents. De plus si les différents endroits ne sont pas équidistants, les paires libres se placeront préférentiellement le plus loin.
cas de 3 paires électroniques :
AX3E0 AX2E1
forme de la molécule : triangle plan fer à cheval BF3 O3
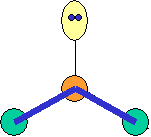
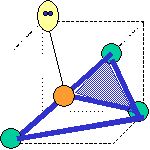
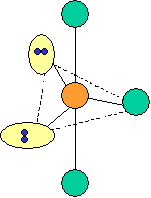
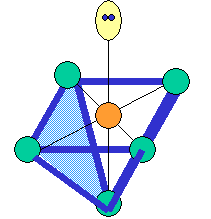
cas de 4 paires électroniques :
AX4E0 AX3E1 AX2E2
forme de la molécule :
tétraèdre pyramide à base triangulaire coudée CH4
NH3
H2O
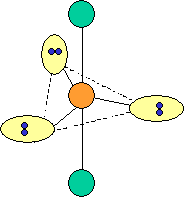
cas de 5 paires électroniques :
AX5E0 AX4E1 AX3E2 AX2E3 forme de la molécule : bipyramide à base triangulaire carré plié en forme de "T" linéaire PCl5 SF4 ClF3 XeF2
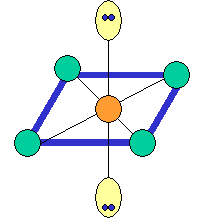
cas de 6 paires électroniques :
AX6E0 AX5E1 AX4E2 forme de la molécule : bipyramide à base carrée pyramide à base carrée carré plan SF6 IF5 XeF4
(c) Animated gif : Robyn Rindge '98 | www.chimmybear.com
Visualiser les molécules - Simulateur
|
| |||||||||
|
Copyright (c) 2000 - 2023 | Miseur Ludovic | www.lachimie.net | tous droits réservés | remis à jour le : 06/07/2023 |
|
|
|
Comment citer cette page : |
| Miseur, L. (2023). Lachimie.net - Forme et géométrie moléculaire. La Chimie.net. http://www.lachimie.net | |
|
|