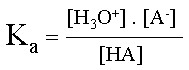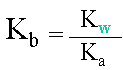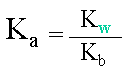Force des acides et des bases
I. Force des acides
La force d'un acide est la tendance qu'a celui-ci à céder un H+ (proton) à l'eau. Elle se détermine sous la forme d'une constante d'équilibre particulière, Ka. L'acide peut céder plus ou moins facilement son proton ; il est plus ou moins fort.
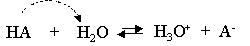
Si un acide est très fort, il cède très facilement un proton, sa base conjuguée sera alors très faible (HCl et Cl-).
Dans un couple acide-base, si l'acide est fort, la base est faible et inversement
Détermination de la formule de la constante d'acidité :
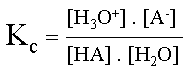
Ka = Kc . [ H2O]
Si Ka est "grand", la réaction est complète, l'acide sera fort.
Si Ka est "petit", la réaction est équilibrée, l'acide sera faible.
|
Déterminer la constante d'acidité de l'acide benzoïque sachant que
|
|
|
II. Force des bases
La force d'une base est la tendance de celle-ci à capter un ion H+, un proton à l'eau.
Détermination de la formule de la constante Kb :
Kb = Kc . [ H2O ]
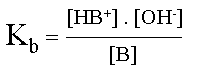
III. Relation entre Ka et Kb
Démonstration
| Soit le couple acido-basique HF/F- | ||||
| Écriture de la demi-équation pour l'acide, | ||||
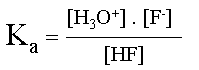 |
sa constante d'acidité s'exprime sous forme d'une constante d'équilibre. | |||
| Écriture de la demi-équation pour la base conjuguée, | ||||
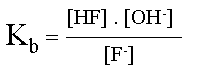 |
sa constante de basicité s'exprime sous forme d'une constante d'équilibre. | |||
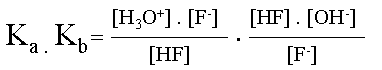 |
L'on écrit le produit de ses constantes obtenues. | |||
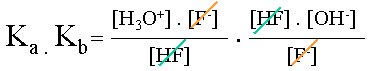 |
Simplifications. | |||
| Le produit de la constante d'acidité et de basicité d'un couple acido-basique est égale au produit des concentrations en ions H3O+ et OH-. | ||||
| Ce produit d'ions est aussi égal à la constante du produit ionique de l'eau Kw, qui vaut 10-14. | ||||
|
L'on peut ensuite exprimer la relation liant les constantes. |
Les constantes Ka et Kb évoluent entre des valeurs allant de 1010 à 10-20, ainsi comme pour le pH, il existe une façon de réduire l'échelle, pour pouvoir comparer plus facilement les valeurs entre elles ou pour faciliter les calculs. Il s'agit des notions de PKa et PKb.
PKa = - log Ka ; PKb = - log Kb
IV. Acides forts, faibles ou de forces nulles
Pour les composés dont la valeur de Ka est supérieure à 55,5, l'on peut considérer que la réaction est complète dans le sens de l'acide et impossible dans celui de la base. L'acide est fort et la base conjuguée est de force nulle.
Pour les composés dont la valeur de Ka est comprise entre 55,5 et plus grande que 1,8.10-16, l'on peut considérer que la réaction aboutit à un état d'équilibre. Ces composés sont des acides et bases faibles.
Pour les composés dont la valeur de Ka est égale ou inférieure à 1,8.10-16, l'acide est de force nulle (réaction impossible) et la base forte (réaction complète).
V. Rôle nivelant de l'eau ( ne concerne que les acides forts : Ka < 55,5!)
Des acides forts aux forces différentes sont rendus de même niveau de force d'acide que H3O+ dans l'eau. H3O+ est l'acide le plus fort pouvant exister dans l'eau et OH- est la base la plus forte existant dans l'eau.
 |
légende :
|
 |
VI. Les sels
VI.1. Rappels : formule générale
|
formules |
dissociation dans l'eau |
catégories |
| MX | M+ (aq) + X- (aq) | sel binaire |
| MXO | M+ (aq) + XO- (aq) | sel tertiaire |
| RCOOM | M+ (aq) + RCOO- (aq) | sel organique |
M = un élément métallique, X = un non-métal, R = une chaîne carbonée.
VI.2. pH d'un sel
Pour déterminer le pH d'un sel, il faut décomposer celui-ci en ions. Lorsque la dissociation est faite, regarder dans quelle catégorie se classent ces ions (acide forts, faibles, de force nulle, bases, ...). Ce classement permettra de voir de quel élément dépend l'acidité et donc le pH. Le pH dépend toujours de la substance la plus "forte".
VI.2.1. Sel neutre : pH = 7
[K+] et [Cl-] n'influence pas le milieu. Le pH est déterminé par l'eau. Or, le pH de l'eau vaut 7.
VI.2.2. Sel acide : pH < 7
La base Br - n'ayant aucune force, c'est l'acide NH4+ qui donnera le caractère acide du milieu
VI.2.3. Sel basique : pH > 7
L'acide Na+ n'ayant aucune force, c'est la base CO32- qui donne le caractère basique du milieu.
|
Copyright (c) 2000 - 2023 | Miseur Ludovic | www.lachimie.net | tous droits réservés | remis à jour le : 06/07/2023 |
|
|
|
Comment citer cette page : |
| Miseur, L. (2023). Lachimie.net - Force des acides. La Chimie.net. http://www.lachimie.net | |
|
|