Les piles
Une application directe de la réaction redox est le phénomène des piles.
Principe général d'une pile : Transformation d'énergie chimique en énergie électrique. Nous définirons le courant comme étant un déplacement d'électrons.
I. La pile Daniell
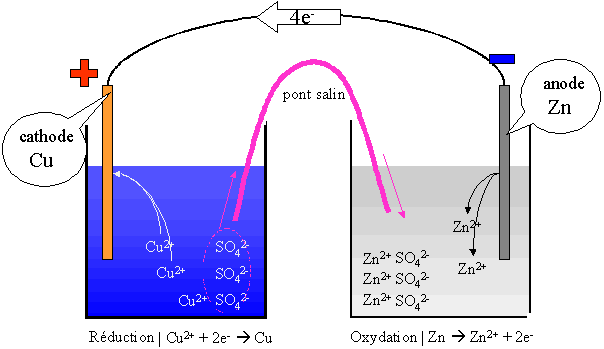
Deux couples sont en présence dans cette pile : Cu / Cu2+ (SO42-) et Zn / Zn2+ (SO42-). Le couple Cu/Cu2+ fera une réduction et le couple Zn/Zn2+ fera une oxydation.
l'oxydation se fait à l'anode (électrode négative) et la réduction se fait à la cathode (électrode positive).
Au départ, [Cu2+] = [SO42-] et [Zn2+] = [SO42-]
En fonctionnement, [Cu2+] < [SO42-] et [Zn2+] > [SO42-].
L'électrode de cuivre augmente de masse au cours du temps tandis que l'électrode de zinc va diminuer de masse au cours du temps.
Le pont salin va permettre aux ions SO42- de circuler d'un berlin à l'autre, afin que l'électro neutralité soit maintenue dans chacun des berlins. Ce pont est constitué soit d'un papier mouillé avec une solution d'un sel (NaCl, KCl, ...) soit d'un pont liquide constitué de la solution saline.
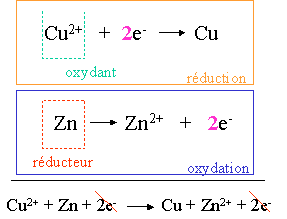
II. La pile Leclanché, pile saline
Les deux couples redox de cette pile sont : MnO2/Mn2+ et Zn2+/Zn
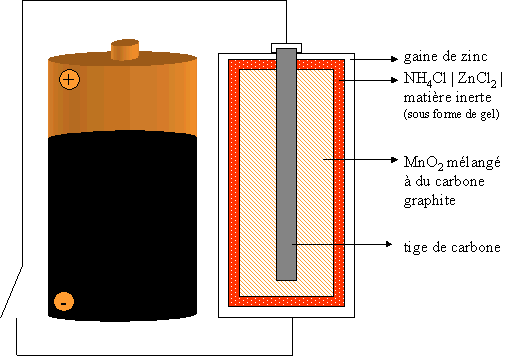
En fonctionnement, à la borne positive (cathode), une réaction de réduction se fait : la réduction de MnO2 en Mn2+ suivant l'équation ci-dessous :
MnO2 (s) + 4 H+ (aq)
+ 2e- ![]() Mn2+ (aq)
+ 2 H2O (l)
Mn2+ (aq)
+ 2 H2O (l)
A la borne négative, anode, c'est une réaction d'oxydation qui s'effectue :
Zn (s) ![]() Zn2+
(aq) + 2e-
Zn2+
(aq) + 2e-
Le gros problème de cette pile est que son "emballage" réagit ! En effet, l'enveloppe de Zinc s'amincit au cours du temps et finit par percer. La pile finit par se trouer et la solution qu'elle contient s'écoule dans l'appareil. la solution étant corrosive, elle cause des dégâts à terme à l'appareil.
III. La pile Alcaline
Il s'agit d'une variante de la pile Leclanché. Cette pile est appelée alcaline car elle fonctionne en milieu basique (KOH).
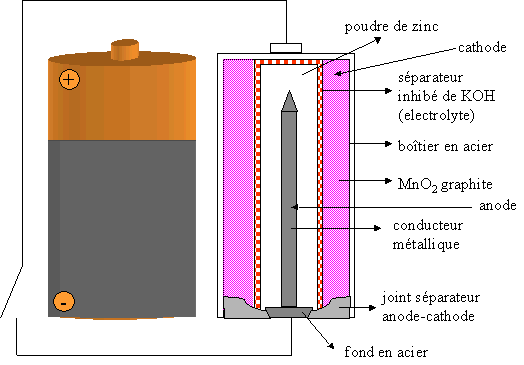
En fonctionnement, à la borne positive (cathode), une réaction de réduction se fait : la réduction de MnO2 en Mn2+ suivant l'équation ci-dessous :
MnO2 + 2 H2O + 2e-
![]() Mn(OH)2 + 2 OH-
Mn(OH)2 + 2 OH-
A la borne négative, anode, c'est une réaction d'oxydation qui s'effectue :
Zn + 2 OH- ![]() Zn(OH)2 + 2e-
Zn(OH)2 + 2e-
Avantages de cette pile :
Elle est plus étanche que la pile Leclanché car le zinc ne constitue plus le boîtier extérieur.
Elle a une durée de vie plus longue car elle renferme plus de MnO2 (oxydant) et de Zn (réducteur) dans le même volume qu'une pile Leclanché.
IV. Autres piles
Il existe encore d'autres types de piles qui ne seront plus détaillée dans ce cours.
| Pile au mercure | Zn/Zn++ et Hg/Hg++ |
réaction en fonctionnement :
Zn + HgO + H2O + 2KOH ---------> Hg + [Zn(OH)4]K2
| Pile à combustible | 1,23 volt | H2/H+ et O--/O2 |
réactions en fonctionnement :
| H2 + 2 OH- --------> 2 H2O + 2e | 0,83 volt | |
| 2e + ½ O2 + H2O --------> 2 OH- | 0,40 volt |
|
Copyright (c) 2000 - 2023 | Miseur Ludovic | www.lachimie.net | tous droits réservés | remis à jour le : 06/07/2023 |
|
|
|
Comment citer cette page : |
| Miseur, L. (2023). Lachimie.net - Les piles. La Chimie.net. http://www.lachimie.net | |
|
|