Modèle atomique quantique - Intro
Le modèle atomique de Bohr rend compte d'une série de phénomène expérimentaux. Toutefois, il ne permet pas d'expliquer toutes les propriétés de la matière. Ce modèle s'est avéré inexact car il appliquait des principes de la mécanique classique (lois de Newton, ...). En réalité au niveau des particules, un autre type de physique s'applique et les échanges d'énergies sont alors limités et discontinus, quantifiés.
A cause de cette quantification de l'énergie que postulait Marx Planck, d'autres lois physiques ont été définies et utilisées. Celles-ci permettent de rendre compte des observations réalisées au niveau atomique et font le lien avec la physique classique. En voici les grands principes afin de comprendre le modèle de l'atome quantique.
I. Dualité onde-corpuscule :
La remise en cause la plus importante à laquelle oblige la physique quantique concerne la manière de représenter les objets physiques et leurs propriétés. L'ancienne physique, dite classique, distingue deux sortes d'entités fondamentales:
- les corpuscules, qui sont des sortes de billes microscopiques,
- les ondes, qui se propagent dans l'espace un peu comme le mouvement d'une vague sur la mer.
La physique quantique ne retient pas cette classification pourtant bien commode.
Les objets qu'elle considère ne sont ni des corpuscules, ni des ondes,
mais "autre chose".
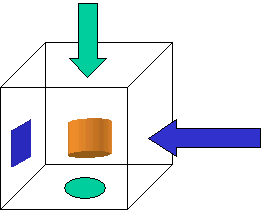
Analogie :
Regardé sous deux angles différents, un cylindre nous apparaît tantôt
comme un cercle, tantôt comme un rectangle. Pourtant il n'est ni l'un ni
l'autre.
Ainsi en est-il du photon, de l'électron ou de toute particule élémentaire
dont l'image corpusculaire ne serait qu'une facette d'une entité plus complexe.
II. propriété ondulatoire et corpusculaire de la lumière
A la fin du XIXe siècle, James Maxwell définit la lumière comme étant un faisceau d'ondes électromagnétiques se déplaçant à vitesse constante dans le vide: la constante c = 300.000 kilomètres par seconde.
Lumière :
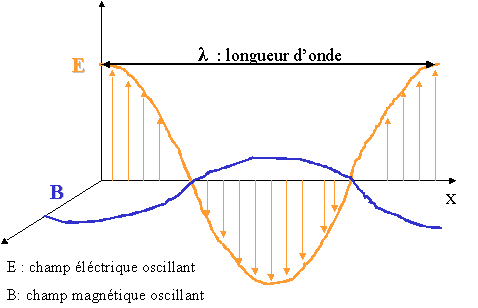
La lumière est caractérisée par sa fréquence (inverse du temps mis par l'onde pour revenir à sa position initiale) ou sa longueur d'onde. La lumière visible n'est donc qu'une partie infime de l'ensemble des ondes électromagnétiques.
Mais la lumière est aussi composée de "grains de lumière" selon Albert Einstein qui soutiendra
que l'énergie de la lumière est en quelque sorte "granuleuse".
Ce "grain d'énergie" sera appelé photon en 1926. Une nouvelle
particule est née, particule immatérielle et sans masse.
Chaque photon d'un rayonnement (lumière, ondes radios, rayons X...) est
porteur d'un quantum d'énergie (un certain "paquet") caractéristique
de sa fréquence (fréquence de la lumière = couleur).
La physique quantique va donc associer une onde et une particule. Cette
association se généralisera d'ailleurs à toute particule, et notamment
l'électron.
Mais comment concilier du continu (ondes) avec du discontinu (particules)?
C'est tout le paradoxe de la dualité onde-corpuscule
III. Origine de la lumière :
La physique quantique permet de mieux comprendre comment la lumière
est émise par la matière...
Le modèle de l'atome de Niels Bohr était un modèle à la
frontière de deux âges: l'âge classique pré-quantique et le monde
quantique. Mais il expliquait déjà le mécanisme de l'émission de lumière
par un atome :
Pour rappel :
 |
Selon le modèle de Bohr, l'électron tourne
autour du noyau, sur une couche électronique bien définie*.
(*) résultats de son expérimentation ! |
 |
Sous l'effet de l'énergie thermique (chaleur) ou électrique ou encore par une onde électromagnétique (photon), l'électron est excité par cette énergie qu'il absorbe et saute sur une couche électronique plus énergétique. |
 |
L'électron est sur une couche électronique plus énergétique. Cette situation est instable et le besoin de stabilité l'amène à perdre cette énergie pour se rapprocher du noyau. |  |
L'électron revient sur sa couche électronique, à son état fondamental. Lors de son retour, il libère, sous forme d'énergie lumineuse (photons), l'énergie thermique ou électrique qu'il avait absorbée. |
 |
L'électron est à nouveau sur sa couche électronique définie. |
Ressources
de ce résumé: © Copyright 1997 |
|
L'énergie de ce photon, la différence d'énergie entre l'état stable et excité, sera un multiple entier (la fameuse quantification de la lumière) de la valeur hn.
- h est un nombre constant universel appelé constante de Planck. h = 6,62 x 10 -34 J.s (Joule-seconde).
- n (lettre grecque nu) est la fréquence de la lumière (ou photon) émise. Cette fréquence est le nombre d'oscillations de l'onde lumineuse par seconde. Elle se mesure en Herz ou Hz. Plus la fréquence de la lumière est élevée, plus son énergie est importante et plus la couleur tend vers le bleu (et au-delà l'ultraviolet, les rayons X et Gamma). Un électron, faisant un "grand saut" d'une orbite atomique à une autre, émettra donc un photon d'autant plus énergétique et donc de fréquence d'autant plus élevé.
Inversement, l'électron d'un atome pourra absorber un photon d'énergie donnée et ainsi "sauter" d'une orbite peu énergétique à une orbite plus énergétique. Il sera ainsi excité sur une orbite plus énergétique que la normale. C'est en se désexcitant qu'il pourra réémettre un photon.
La théorie quantique
stipule que toutes les orbites électroniques ne sont pas autorisées. Ces
orbites ne sont permises que dans la mesure où un électron, sautant
d'une orbite à une autre, peut émettre ou absorber un photon d'une énergie
multiple de la fameuse valeur hn. C'est
cette discontinuité quantique de l'énergie échangée qui entraîne une
discontinuité des orbites permises. Chaque orbite électronique autorisée sera
donc quantifiée et caractérisée par des nombres quantiques.
IV. Spectre lumineux
Chaque atome ne peut donc émettre qu'une palette précise de couleurs caractéristiques : Chaque couleur de la lumière est en fait une fréquence particulière (et donc un niveau d'énergie) de photon.
Par exemple : le spectre d'émission de lumière visible du cuivre (Cu++)
Tous les sauts d'électrons entre toutes les orbites possibles
au sein d'un même atome se traduisent donc par l'émission (ou l'absorption) d'un spectre de lumière caractéristique: Il s'agit
là d'une véritable carte d'identité d'un type d'atome donné. C'est grâce
à ce spectre facilement identifiable que l'on peut savoir quels atomes
existent dans les étoiles du firmament. Leur lumière est captée par les
télescopes, analysée et comparée avec les spectres de l'hydrogène, de
l'hélium etc...
![]()
Spectre des ondes électromagnétiques :
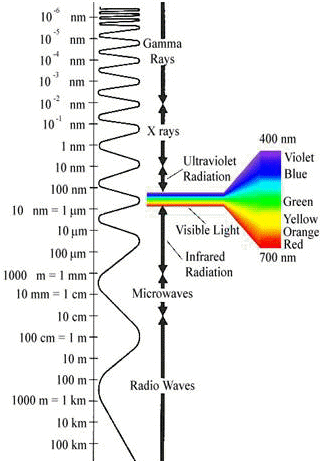
D'après http://perso.club-internet.fr/molaire1/quantic.html | (c) Illustrations : WOLLBRETT Cyberic
|
Copyright (c) 2000 - 2023 | Miseur Ludovic | www.lachimie.net | tous droits réservés | remis à jour le : 06/07/2023 |
|
|
|
Comment citer cette page : |
| Miseur, L. (2023). Lachimie.net - Modèle atomique quantique (intro). La Chimie.net. http://www.lachimie.net | |
|
|