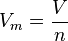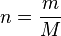Volume molaire d'un gaz parfait
I. Définition
- Le volume molaire d'un gaz parfait est le volume occupé par une mole de n'importe
quel gaz parfait dans des conditions normales
de température et de pression.
( à savoir : 1,013.105 Pa [1013 hPa] et 0° Celsius [273,15
Kelvin]). Cette condition se note
CNTP ou TPN.
- Ce volume est de 22,41 L - 0,02241 m³ dans les conditions NTP.
- Sauf indications contraires, le volume molaire d'un gaz est toujours exprimé selon les CNTP !
- 1 mole de composé à l'état gazeux occupera un volume de 22,4 L
unité du volume molaire :
Son unité est le litre par mole (L·mol-1). Dans les unités du système international, le volume molaire s'exprime en mètres cubes par mole (m3·mol-1).
- Conditions de laboratoire | Convention (CL)
Pression = pression atmosphérique (1013 hPa) et température fixée à 25°C (298,15 Kelvin) ; Le volume molaire d'un gaz vaut alors 24,47 L·mol-1 que nous estimerons à 24 L·mol-1
Le volume molaire est une grandeur physico-chimique qui dépend de l'élévation de la température et de la pression.
II. Formules
Le volume molaire peut se calculer en utilisant la formule :
Cette formule s'applique aux gaz uniquement avec
-
V , le volume en litres et
-
n la quantité de matière en moles.
En utilisant la formule de calcul de la masse molaire M
on peut déterminer une seconde formule :
-
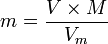 .
.
![]() Pour calculer le
nombre de moles d'un gaz parfait dans d'autres conditions, la formule suivante est à appliquer :
P. V = n. R. T. où, P = la pression exprimée en Pa, V
est égale au volume (en m³), n est la quantité de matière (nombre
de moles), R = la constante du gaz parfait (8,314) et T, la température
absolue exprimée avec l'échelle de Kelvin.
Pour calculer le
nombre de moles d'un gaz parfait dans d'autres conditions, la formule suivante est à appliquer :
P. V = n. R. T. où, P = la pression exprimée en Pa, V
est égale au volume (en m³), n est la quantité de matière (nombre
de moles), R = la constante du gaz parfait (8,314) et T, la température
absolue exprimée avec l'échelle de Kelvin.
On peut aussi utiliser la relation des gaz parfaits :
-
pV = nRT
afin de déterminer le volume molaire selon la formule :
-
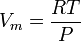 .
.
Dans les exercices, nous utiliserons pour la pression : 1 atm , le volume sera exprimé en litre , et R vaudra alors 0,082. Il s'agit d'unités plus courantes en chimie et en thermodynamique chimique.
|
|
|
|
 | |
Réservé à une utilisation strictement privée-tous droits de reproduction et de diffusion réservés - (c) L. Miseur - La chimie.net 2012 | |
|
Copyright (c) 2000 - 2023 | Miseur Ludovic | www.lachimie.net | tous droits réservés | remis à jour le : 06/07/2023 |
|
|
|
Comment citer cette page : |
| Miseur, L. (2023). Lachimie.net - Volume molaire d'un gaz. La Chimie.net. http://www.lachimie.net | |
|
|