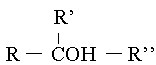Les
alcools
I. formule générale
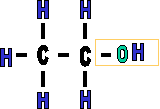 |
Cn H2n+1OH, valable uniquement pour les molécules ne possédant qu'une fonction alcool. Il existe aussi des molécules alcènes sur lesquelles viennent se fixer des fonctions alcools. Dans ce cas la formule générale est Cn H2n-1OH. La fonction alcool prend toujours la place d'un hydrogène. |
Les alcools sont des molécules saturées, car un même atome de carbone,
est entouré par 4 éléments distincts.
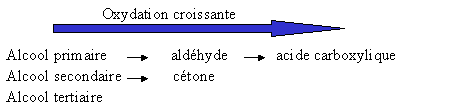
Les alcools se divisent encore en trois catégories : primaire, tertiaire et secondaire.
|
Formule générale |
nom |
caractéristiques |
|
R-CH2-OH |
primaire | Un alcool est primaire si la fonction alcool
(-OH) se trouve en fin ou en début de chaîne.
Butan-1-ol |
|
|
secondaire | Un alcool est secondaire si la fonction alcool
se trouve dans la chaîne carbonée.
Butan-2-ol ; butan-3-ol |
|
|
tertiaire | Un alcool est tertiaire si sur un même carbone
se trouvent une ramification et la fonction alcool.
Méthylpropan-2-ol |
L'oxydation (perte d'électrons) de ces composés donne d'autres composés aux fonctions différentes :
II. Géométrie de la fonction alcool
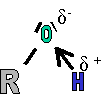 |
Le R représente une chaîne carbonée alcane ou alcène sur laquelle vient se greffer une fonction alcool. La molécule est polaire, car la différence d'électronégativité entre l'oxygène et l'hydrogène fait apparaître des charges partielles qui ne se compensent pas. |
La forme de la fonction alcool est donc un "V", cette forme et la
polarité attribueront des propriétés spéciales
aux alcools.
III. Nomenclature
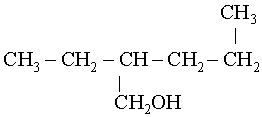 |
|
|
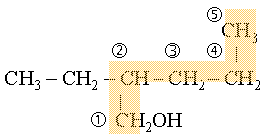 |
|
4. Déterminer et placer la/les ramification(s), puis citer le nom de la chaîne
carbonée en spécifiant de quel type de chaîne carbonée il s'agit alcane ou
alcène.
Ce
qui donne : 2-éthylpentan-1-ol
|
|
1. Lorsqu'il y a présence d'un alcène, nommer comme suit : position
–ramification + préfixe alcène + position double liaison + ène +
position fct alcool + OL 2. Lorsqu'il y a plusieurs alcools, procédés comme pour les alcènes,
citer les deux positions des groupements (-2,3-) et terminer par :
si 2 alcools : diol
Si 3 alcools : triol |
| exemple de nomenclature pour un alcool avec chaîne carbonée alcène : | |
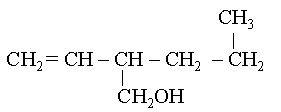 |
2-propylbut-3-èn-1-ol.
|
|
|
|
|
IV. Propriétés
IV.1. Température d'ébullition
Les alcools ont une température bien plus élevée que les alcanes ou
alcènes de masses molaires semblables,
par exemple, l'éthane à une température d'ébullition de -89°C, alors que l'éthanol
a lui, une température d'ébullition de + 78°C.
Si la température d'ébullition est beaucoup plus importante, c'est que la molécule se comporte comme une molécule plus lourde que ce qu'elle est réellement.
Cela est du à la présence dans les molécules d'alcool du groupement OH. Dans ce groupement, la liaison O-H est fortement polarisée vers l'atome O, élément le plus électronégatif
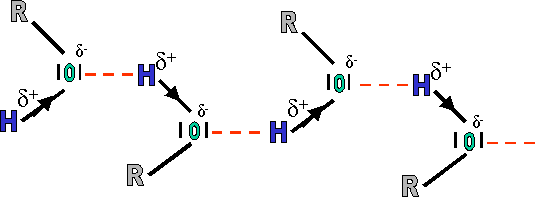
En fait, les oxygène et hydrogène de chaque molécule sont attirés l'un par l'autre (δ+ et δ- s'attirent). Il s'agit d'une action électrostatique entre l'oxygène (δ-) d'une molécule et l'hydrogène (δ+) d'une seconde. Ces liaisons électrostatiques sont appelées "ponts hydrogène". L'énergie fournie devra donc d'une part briser ses ponts hydrogène et seulement ensuite pourra porter à ébullition la molécule. (2 fois plus de travail à effectuer, donc plus grand besoin en énergie).
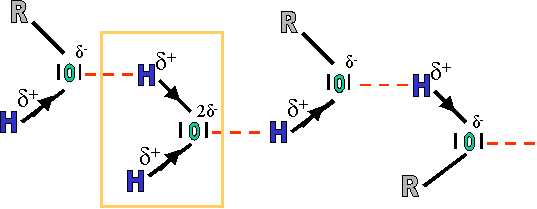
IV.2. Solubilité
Méthanol, éthanol et propan-1-ol sont solubles dans l'eau en toutes proportions. C'est la présence du groupement hydroxyle (OH) dans les molécules d'eau (H2O) et d'alcool, et la possibilité de formation de ponts hydrogène entre les molécules d'eau et d'alcool qui explique cette grande solubilité, pour autant que la chaîne carbonée ne soit pas trop longue !
IV.3. Combustion
Comme tous les composés organiques contenant du carbone, les alcools peuvent
réaliser la combustion.
Alcool + O2
---> CO2 +
H2O + E (à
pondérer)
|
|
Que signifie l'inscription en ° sur une bouteille d'alcool ? (par exemple une bière à 5°) |
| Cela signifie que pour 100 mL de boisson, à une température de 15°C, La boisson renferme 1 mL d'alcool. Donc pour notre exemple, une bière contiendra 5 mL d'alcool pour 100mL de liquide à 15°C (La limite autorisée est de 0.5g/litre de sang en Belgique). |
|
Copyright (c) 2000 - 2023 | Miseur Ludovic | www.lachimie.net | tous droits réservés | remis à jour le : 06/07/2023 |
|
|
|
Comment citer cette page : |
| Miseur, L. (2023). Lachimie.net - cours de chimie et ressources didactiques pour apprendre les savoirs disciplinaires, les savoir-faire et compétences de base des sciences chimiques. La Chimie.net. http://www.lachimie.net | |
|
|