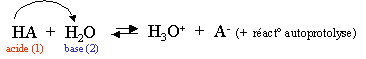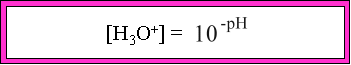L'autoprotolyse de l'eau et le pH
I. L'autoprotolyse de l'eau
Mesurons la conductivité d'une solution d'eau déminéralisée ( qui à priori ne contient pas d'ions). La mesure de conductivité obtenue n'est pas nulle, à 25°C, la conductivité de l'eau déminéralisée est de 5,5 .10-6 S.
L'eau déminéralisée contient donc des ions. Voici l'équation de la réaction acido-basique de l'eau :
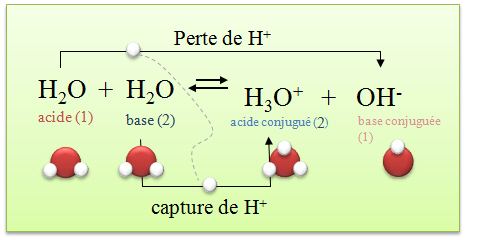
Les couples acides-bases sont : H2O/OH- et H3O+/H2O.
Il y a donc des ions libres dans l'eau. La conductivité est cependant très faible, cette réaction doit donc aboutir à un état d'équilibre avec de très faibles concentrations de OH- et H3O+. Cet état d'équilibre est appelé équilibre d'autoprotolyse de l'eau. Comme il s'agit d'une réaction aboutissant à un état d'équilibre, nous pouvons calculer la constante d'équilibre, celle-ci est particulière et se note Kw.
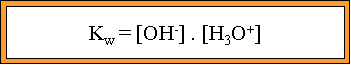
Dans toute solution aqueuse, le produit des concentrations des ions OH- et H3O+ est une constante. Ce produit se nomme PRODUIT IONIQUE DE L'EAU. Sa valeur est de :

Attention ! Cette valeur n'est valable qu'à 25°C, en effet Kw varie avec la température. Voici des mesures expérimentales prises à différentes températures :
| T (°C) | 0 | 15 | 20 | 25 | 30 | 60 | 100 |
| Kw | 2 . 10-15 | 2 . 10-15 | 4,5 .10-15 | 10-14 | 4,5 . 10-14 | 10-13 | 3,7 .10-13 |
Concentration des ions OH- et H3O+ dans l'eau pure.
équation : 2 H2O ![]() H3O+ + OH- ; dans l'eau pure il y a
autant de mole d'ions OH- que de mole d'ions H3O+.
Nous pouvons donc retrouver les concentrations de ces ions.
H3O+ + OH- ; dans l'eau pure il y a
autant de mole d'ions OH- que de mole d'ions H3O+.
Nous pouvons donc retrouver les concentrations de ces ions.
![]()
II. Milieu acide, milieu basique
II.1. Un acide dans l'eau :
=> Une solution est acide si : [H3O+] > [OH-].
Exemple :
[ H3O+] = 10-3 mol.L-1 => [OH-] = 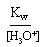
= 10-14/10-3 = 10-11 mol.L-1 II.2. Une base dans l'eau :
=> Une solution est basique si [H3O+] < [OH-].
Exemple :
[OH-] = 10-4 mol.L-1 => [H3O+] = 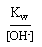
= 10-14/10-4 = 10-10 mol.L-1
III. Echelle d'acidité et pH
III.1.Echelle de pH
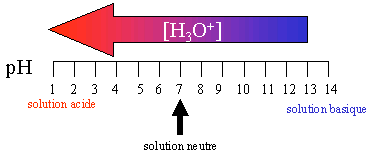
Cette échelle basée sur la concentration en ions H3O+ n'est pas très pratique, car les concentrations peuvent varier de 10-14 à 1 ! Une autre échelle a été mise en place pour pouvoir comparer plus facilement l'acidité, il s'agit de l'échelle de pH.
Le pH d'une solution est égale à la relation :
où log est la fonction logarithmique en base 10 et
[H3O+] est la concentration en ions H3O+.
Exemple : si une solution acide a une concentration en H3O+ égale à 10-8 son pH = -log 10-8 = 8
si [H3O+] = 10-5 ; pH = -log 10-5 = 5.
Par conséquent, connaissant le pH, l'on peut retrouver la concentration en ions [H3O+] par la relation suivante :
Sur l'échelle des pH, l'acidité ne varie donc que de 0 à 14.
Notons que lorsque le pH augmente, la concentration en H3O+ diminue.
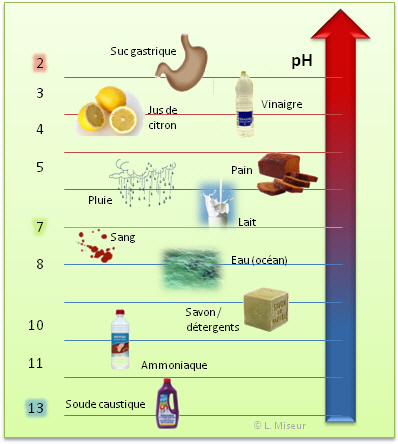
III.2. Quelques exemples de la vie courante

III.3. Mesure du pH
Il existe deux méthodes permettant de mesurer le pH d'une solution :
III.3.1. Les papiers indicateurs universels.
Pour mesurer le pH, il suffit de déposer une goutte de solution sur la languette de papier pH et de comparer la couleur obtenue avec le panel de couleurs fourni avec le papier. Attention ! Un papier pH est composé d'un mélange de différentes substances qui changent de couleurs selon les concentrations en H3O+ que contient la solution. Voici un tableau de ces différentes substances ainsi que la valeur de pH pour laquelle elles changent de couleur : (On peut également utiliser ces substances seules directement dans les solutions pour déterminer le pH selon la couleur obtenue).
(c) Claude Abraham : http://cabraham.ep.profweb.qc.ca
III.3.2. Le pH-mètre :
Il s'agit d'un appareil constitué de deux parties : une électrode que l'on plonge dans la solution et un voltmètre électronique dont l'échelle est graduée directement en unités de pH.
IV.Exercices
![]()
|
Copyright (c) 2000 - 2023 | Miseur Ludovic | www.lachimie.net | tous droits réservés | remis à jour le : 06/07/2023 |
|
|
|
Comment citer cette page : |
| Miseur, L. (2023). Lachimie.net - Autoprotolyse de l'eau et le pH. La Chimie.net. http://www.lachimie.net | |
|
|