Déplacement de l'équilibre chimique
I. Principe de Le Chatelier
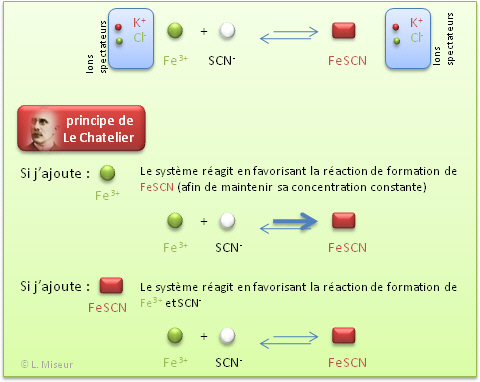
Si on impose une modification (concentration, température, pression) à un système chimique en équilibre, le système évolue vers un nouvel état d'équilibre de manière à contrecarrer la modification introduite.
Si on chauffe un mélange dont la réaction directe est exothermique, le système en trop grande quantité de chaleur l'évacuera en réalisant une réaction endothermique, soit la réaction inverse.
II. Différentes modifications
Influence de la concentration
1. réaction directe | 2. réaction inverse
Si on augmente la concentration en I- <=> le système diminue la concentration en I- en faisant la réaction directe : Kc devient plus grand.
Influence de la température (chaleur / apport ou retrait d'énergie)
= réaction exothermique dans le sens direct et endothermique dans le sens inverse.Si on chauffe le système <=> le système tend à diminuer la température, le système fera la réaction inverse (endothermique), Kc devient plus petit.
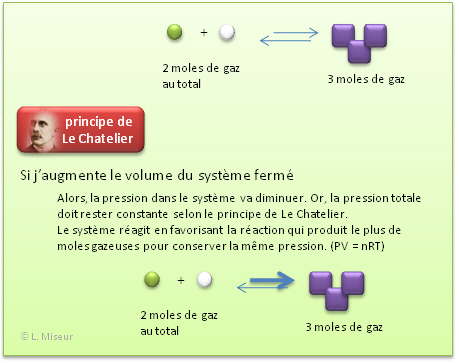
Influence de la pression (uniquement si des composés gazeux sont présents dans la réaction)<
, soit le cas d'une bouteille d'eau gazeuse.
Si on ouvre la bouteille, la pression diminue <=> le système tendra à augmenter la pression, c'est-à-dire: augmenter le nombre de molécules gazeuses, soit effectuer la réaction directe.
|
|
 |
|
|
|
Copyright (c) 2000 - 2023 | Miseur Ludovic | www.lachimie.net | tous droits réservés | remis à jour le : 06/07/2023 |
|
|
|
Comment citer cette page : |
| Miseur, L. (2023). Lachimie.net - Principe de Le Chatelier. La Chimie.net. http://www.lachimie.net | |
|
|