L'électrolyse
Introduction
L'électrolyse est le phénomène inverse du phénomène de la pile. Il s'agit d'un phénomène non spontané, forcé.
Il faut, grâce à un apport d'énergie électrique extérieure, forcer la réaction chimique non spontanée.
Lors d'un phénomène d'électrolyse, de l'énergie électrique est transformée en énergie chimique. C'est une réaction qui fait intervenir des électrons.
Quelques applications
- purification de métaux (qui sont sous forme de sels)
- plaquage des bijoux en plaqué or
- purification du cuivre à haut niveau
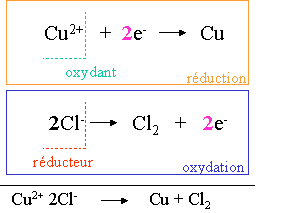
I. Electrolyse du CuCl2
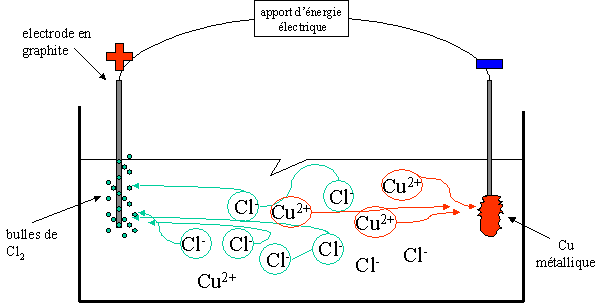
Le CuCl2 en solution (ions Cu2+ et 2 Cl-), est mis en présence d'électrodes de graphite auxquelles sont appliquées une différence de potentiel.
A la cathode, les ions Cu2+ sont réduits en cuivre métallique qui se déposent sur l'électrode.
A l'anode, les ions Cl- se transforment en Cl2 gazeux et du dichlore est dégagé, il y a oxydation à l'anode qui est positive.
Les signes sont donc opposés à l'anode et à la cathode par-rapport au phénomène des piles !
II. Galvanoplastie (fabrication de l'acier galvanisé)
But : déposer une fine couche métallique par électrolyse.
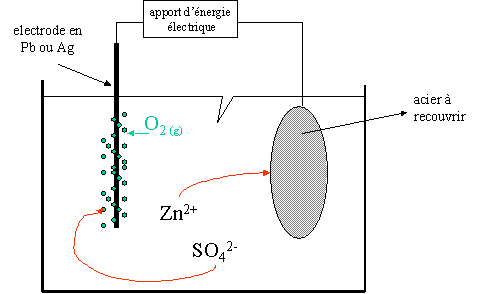
A l'électrode négative constituée par l'acier à recouvrir :
Zn2+ + 2e-
Zn
A l'électrode positive constituée de plomb ou d'argent :
2 H2O
O2 + 4e- + 4H+
L'eau réagit dans cette réaction ! Les couples sont : Zn2+ / Zn et O2 / H2O.
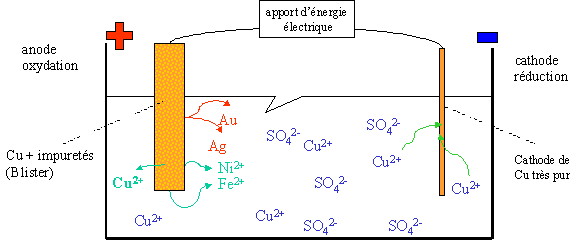
III. L'affinage du Cuivre 
Le cuivre tant utilisé dans la vie de tout le jour est produit à partir de minerais de cuivre extrait du sol et du recyclage. Dans le cycle de transformation du cuivre, différentes méthodes physiques et chimiques sont utilisées dont l'électrolyse. Le cuivre doit être affiné jusqu'à l'obtention d'une pureté de 99,90%.
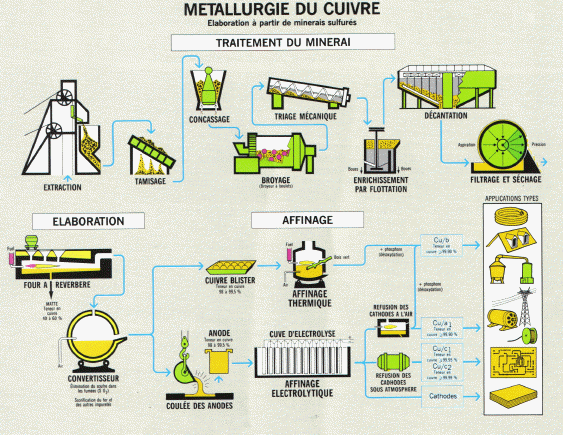
(c) illustrations : Centre d'information du cuivre, laitons et alliages, publication : le cuivre et ses alliages, métallurgie applications. http://www.cuivre.org
Intéressons-nous à ce qu'il se passe au niveau de l'affinage électrolytique :
Les anodes contiennent déjà de 95 à 99,5 % de cuivre mais aussi d'autres métaux : fer, nickel, or, argent, ...
Les différents couples qui entrent en compte dans cette réaction sont au niveau du blister, et par ordre de forces décroissantes :
Au++/Au Ag+/Ag Cu++/Cu Ni++/Ni Fe++/Fe à l'anode : (oxydation)
1. Fe --> Fe2+ + 2e- 2. Ni --> Ni2+ + 2e- 3. Cu --> Cu2+ + 2e- Ag et Au tomberont tels quels dans la solution (forme métallique) à la cathode : (réduction)
1. Cu2+ + 2e- --> Cu Ni2+ et Fe2+ ne réagiraient avec la cathode que s'il n'y avait plus d'ions Cu2+ dans la solution, or la solution est toujours alimentée par le blister (lingot) à l'anode et la solution de CuSO4 est régulièrement remplacée.
|
Copyright (c) 2000 - 2023 | Miseur Ludovic | www.lachimie.net | tous droits réservés | remis à jour le : 06/07/2023 |
|
|
|
Comment citer cette page : |
| Miseur, L. (2023). Lachimie.net - Electrolyse. La Chimie.net. http://www.lachimie.net | |
|
|