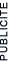La réaction acide-base
I. Définitions acides, bases
I.1. Définition historique
Mise en évidence des acides et des bases grâce aux indicateurs (papier indicateur).
| Les acides ont une saveur aigre, rougissent le papier indicateur (tournesol) et réagissent avec les bases pour former des sels. |
Les bases sont caustiques, ont une saveur amère et bleuissent le tournesol. |
|
Les définitions historiques se contentent de décrire ce qu'il se passe, il s'agit de définitions opérationnelles.
Découverte : de l'acide en pleine nature. (suivez le lien) |
I.2. Définitions d'Arrhenius
1.Un acide est une substance qui en solution aqueuse, libère un ou plusieurs protons (H+).
HCl ![]() H+ (aq) + Cl- (aq)
H+ (aq) + Cl- (aq)
H2SO4 ![]() 2 H+ (aq) + SO42- (aq)
2 H+ (aq) + SO42- (aq)
H3PO4 ![]() 3 H+ (aq) + PO43- (aq)
3 H+ (aq) + PO43- (aq)
2.Une base est une substance qui en solution aqueuse libère un ou plusieurs ions OH-
NaOH ![]() Na+
(aq) + OH- (aq)
Na+
(aq) + OH- (aq)
Ca(OH)2 ![]() Ca2+ (aq) + 2 OH- (aq)
Ca2+ (aq) + 2 OH- (aq)
3.La réaction Acide-base est une réaction où il y a formation d'eau (H2O) et de sel.
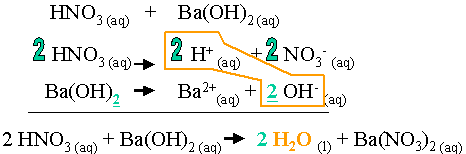
Une mole de Ba(OH)2 libère 2 moles de OH- en solution aqueuse. Une mole de HNO3 libère une mole de H+.
Pour neutraliser les 2 moles de OH- libérées par Ba(OH)2, il faut deux moles de H+. Par conséquent, il faut 2 moles de HNO3. Lors de la réaction, il se formera deux moles d'eau et une mole de sel.
I.3. Limites de la théorie d'Arrhenius
|
H+ + H2O
|
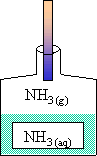
|
I.4. Définition de Bronsted-Lowry
I.4.1. Expérience
 |
 |
|
Réaction entre un acide (HCl) et une base (NH3) en phase gazeuse. Formation d'une fumée de NH4Cl. - http://www.chem.leeds.ac.uk/delights/photos/HCl+NH3/ |
|
I.4.2. Définition d'un acide :
HCl ![]() H+ + Cl-
H+ + Cl-
H2SO4 ![]() H+ + HSO4- [couple : H2SO4/HSO4-]
H+ + HSO4- [couple : H2SO4/HSO4-]
HSO4-
![]() H+ + SO42- [ couple : HSO4-/SO42-]
H+ + SO42- [ couple : HSO4-/SO42-]

I.4.3. Définition d'une base :
Une base est une substance (molécule ou ion) capable de capter (fixer) un H+ (proton).
NH3
+ H+ ![]() NH4+
NH4+
Na+ OH-
+ H+ ![]() H2O + Na+ (couple H2O/OH-)
H2O + Na+ (couple H2O/OH-)

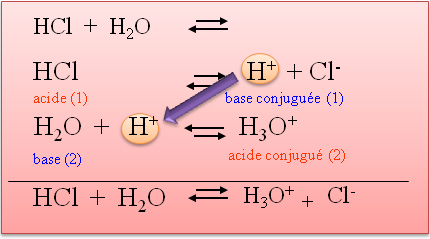
I.4.4. La réaction acide base :
c'est un transfert de H+ (proton) entre deux couples Acides-bases.
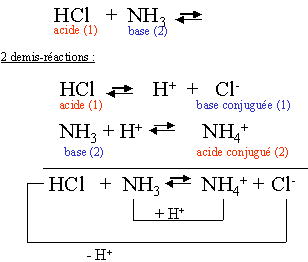
La théorie de Bronsted-Lowry permet d'expliquer également la formation des espèces H3O+ et OH- dans un milieu selon que l'on rajoute à de l'eau un acide ou une base. Et permet donc d'expliquer ce qu'Arrhenius avait découvert. La théorie d'Arrhenius est un cas particulier qui implique les couples H3O+/H2O (où l'eau est alors une base conjuguée de l'acide) et H2O/OH- (où l'eau joue cette fois le rôle de l'acide).
Une substance qui, comme H2O, réagit tantôt en acide, tantôt en base selon le partenaire est appelée AMPHOLYTE.
e) Définition de Lewis* :
La définition de Bronsted-Lowry, bien que résolvant une partie des problèmes qui se posaient avec la théorie d'Arrhenius, ne permet pas encore de caractériser tous les acides et toutes les bases. En effet, dans le tableau périodique, certains éléments peuvent agir tantôt comme acide, tantôt comme base.
Voici quelques acides et bases de Lewis courants :
© Mark R. Leach 1999-2009 | http://www.meta-synthesis.com/
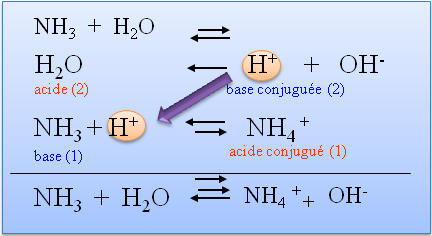
- Un acide est toute espèce qui peut accepter une paire d'électrons offerte par une autre espèce chimique lors d'une réaction.Un acide de Lewis est un accepteur d'électrons (électrophile)
Un acide de Lewis est caractérisé par :
1) une fraction de charge positive sur l'atome central (due à la forte électronégativité des atomes liés à ce centre)
2) la capacité d'accepter une paire d'électron supplémentaire.Exemples : BF3 ,H+, AlH3
- Une base est toute espèce qui possède une paire d'électron non-liante et qui peut offrir une paire d'électrons à une autre espèce chimique lors d'une réaction. Une base de Lewis est donc un donneur d'électrons . (nucléophile)
Exemples : NH3 (1 paire non-liante), H2O (2 paires non-liantes), OH- (1 paire non-liante)
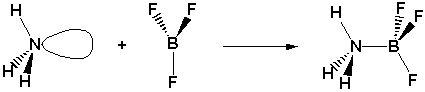
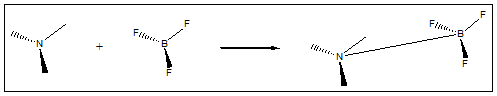
Réaction de BF3 /!\ dans autre solvant que l'eau : (acide de Lewis, le Bore porte une charge partielle positive à cause de la très grande électronégativité des fluors qui captent vers eux les électrons du bore et NH3 est la base, car l'atome d'azote porte une paire d'électrons non-liants.
Remarques
- Le solvant joue souvent le rôle de l'acide ou de la base, ou à la fois de l'acide et de la base.
- L'eau et les solvants polaires peuvent agir soit comme base ou comme acide parce qu'ils ont des sites acides et basiques dans leur structure moléculaire: L'eau peut agir comme base en offrant le partage d'une paire d'électrons libres que l'on y trouvait sur l'atome O , et comme acide par le biais d'éventuelles liaisons hydrogènes..
- Le modèle proposé par Brönsted apparaît ici comme un cas particulier de la théorie de Lewis. En effet, H+ sera l'électrophile et OH- le nucléophile
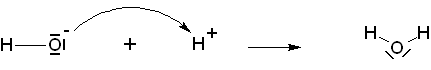
(*) Adapté de Prof. Claude Piguet , Dr. Nadjet Ouali, Dr. Sylvain Koeller , Module 8 – La liaison chimique, Chimie Générale On line, <http://chimge.epfl.ch/Fr/lc/1LC70.htm >, mai 2009
|
Copyright (c) 2000 - 2023 | Miseur Ludovic | www.lachimie.net | tous droits réservés | remis à jour le : 06/07/2023 |
|
|
|
Comment citer cette page : |
| Miseur, L. (2023). Lachimie.net - La réaction acide-base. La Chimie.net. http://www.lachimie.net | |
|
|