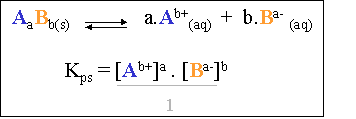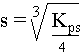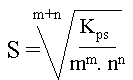La solubilité
I. Introduction
Que signifie exactement les expressions courantes "ce composé est soluble, très soluble ou insoluble" en chimie ? La solubilité d'un composé peut être définie de la façon suivante : une quantité maximale (g ou mole) de soluté dissous dans 1 litre de solution saturée selon des conditions précises de température, de nature du solvant et du soluté.
Une solution est saturée si elle contient une quantité de soluté égale (ou supérieure) à la solubilité.
II. Expression de la solubilité
La solubilité, notée "s" s'exprime le plus souvent en g/L ou en mole/L.
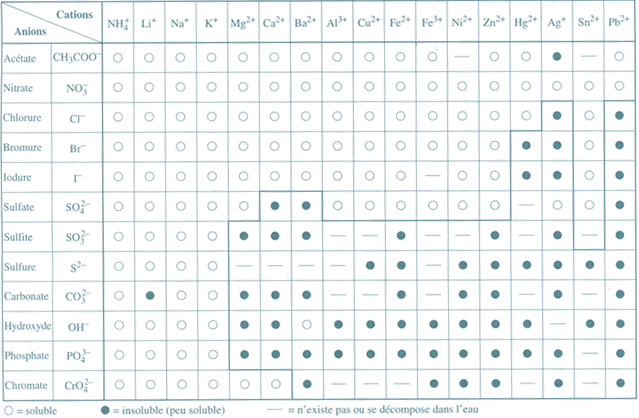
Par convention, un composé est dit soluble si sa solubilité est supérieure à 0,1 mole par litre de solution
Un composé sera dit "peu soluble" si sa solubilité est inférieure à 0,1 mole par litre de solution. Le terme "insoluble" sera utilisé pour des composés très peu solubles.
III. Tableau qualitatif de la solubilité
IV. Équilibre dynamique d'une solution saturée avec excès
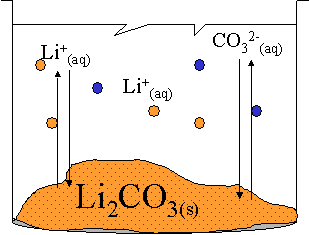 La solution représentée ci-contre est saturée avec un excès de solide. Elle constitue un système à l'état d'équilibre. En effet, la température est constante et l'évaporation est considérée comme négligeable.
La solution représentée ci-contre est saturée avec un excès de solide. Elle constitue un système à l'état d'équilibre. En effet, la température est constante et l'évaporation est considérée comme négligeable.
Comme dans tout système, deux réactions inverses se produisent simultanément : la réaction de dissolution et celle de cristallisation. De plus, la réaction se produit sans que l'on ne puisse en observer les effets directement à l’œil nu.
Il s'agit donc bien d'un système à l'état d'équilibre dynamique, dont l'équation s'écrira :
![]()
L'on peut généraliser ceci pour toute solution électrolyte saturée avec présence d'un excès.
V. Le produit de solubilité
Il s'agit d'une constante d'équilibre comme pour tout système. En appliquant la loi de Guldberg-Waage, l'on obtient une constante d'équilibre dont l'expression est :
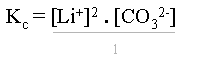 ou
ou ![]()
Les crochets [] signifient la concentration d'ions de Li+, de CO32- ou de tout autre ion se trouvant entre ces crochets.
Cette constante se nomme produit de solubilité de Li2CO3 et s'écrit : Kps Li2CO3. De nouveau, ceci est valable pour toutes les solutions électrolytes saturées avec excès.
Généralisation
Le dénominateur n'intervient pas dans le calcul du produit de solubilité (il est égal à "1"), car il s'agit d'un solide !
VI. Relation entre la solubilité, s, et Kps
La table des produits de solubilité est une liste des constantes obtenues pour différents composés à une température donnée. ( table des Kps - voir boite à outils ). Le produit de solubilité permet de retrouver la solubilité d'un composé.
Exemple :
Zn(OH)2 (s) Zn2+ (aq) + 2 OH- (aq) remplaçons le nombre de moles par "s", nous obtenons : s
s + 2s Or, le produit de solubilité de ce composé est : Kps = [Zn2+] . [OH-]2 Remplaçons par "s" : Kps = s . (2s)² Kps = s. 4s² Kps = 4s³ Nous savons, grâce à la table des produits de solubilité, que celui-ci vaut 4,5.10-17 à 25°C pour ce composé. 4,5. 10-17 = 4s3 s = 2,2 . 10-6 mole/L Généralisation
pour un composé : AmBn (s)
m.Ax+ (aq) + n.By- (aq), la relation entre le Kps et la solubilité est :
|
Copyright (c) 2000 - 2023 | Miseur Ludovic | www.lachimie.net | tous droits réservés | remis à jour le : 06/07/2023 |
|
|
|
Comment citer cette page : |
| Miseur, L. (2023). Lachimie.net - Solubilité. La Chimie.net. http://www.lachimie.net | |
|
|