La réaction chimique
I.1. Mise en évidence
Dans toutes les expériences réalisées, plusieurs substances sont mises en présence et se transforment soit de façon spontanée, soit suite à un apport d'une quantité d'énergie (chaleur, flamme, ...). Essayons de déterminer les substances de départs et celles présentes après réaction. Découvrons également comment représenter cela sous une forme symbolique.
Expérience : ajout d'acide concentré (HCl) dans de l'eau de Javel
Attention Ne pas réaliser à la maison !! Le chlore dégagé pendant la réaction est très toxique !
Les vidéos de ce chapitre ont étés réalisées par W. Escudier et intégrées à ce cours avec son aimable autorisation - http://handbook.free.fr
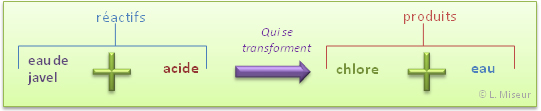
Au départ : Eau de Javel (liquide) et Acide (liquide)
Après réaction : Gaz vert (du Chlore) et un liquide (eau)
I.2. L'équation chimique
Représentons de façon symbolique ce que l'on a observé lors de l'expérience :
La façon de représenter les observations réalisées a été définie par convention par les chimistes. Voici ces conventions :
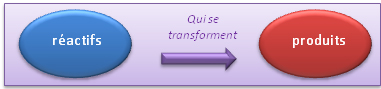
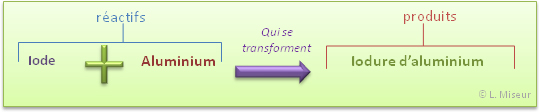
Les composés qui se trouvent à gauche de la flèche, ceux que l'on met en présence avant que la réaction ne se soit déroulée sont appelés réactifs, les composés que l'on récupère après la réaction chimique sont appelés produits et sont à droite de la flèche de réaction.
Ce "+" ne signifie pas simplement que l'on additionne les réactifs. Cela signifie que l'on les mets en présence et qu'ils vont réagir entre eux pour se transformer en produits.
Tentons maintenant de rendre l'équation de la réaction d'ajout d'acide dans de l'eau de Javel plus "universelle" afin qu'elle soit comprise par tous à travers le monde, dans toutes les langues. Pour ce faire, les chimistes désignent les différentes substances par leur formule chimique. Ces formules reflètent la composition au niveau des atomes de ces substances.
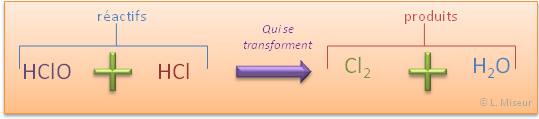
Nous avons donc de l'eau de Javel (principalement constituée de HClO) qui réagit avec de l'acide chlorhydrique (HCl) pour former du dichlore (Cl2) et de l'eau (H2O).
Cela signifie que une molécule composée d'un atome d'hydrogène (H), d'un atome de Chlore (Cl) et d'un atome d'oxygène (O) réagit avec une molécule composée de Chlore (Cl) et d'hydrogène (H) pour former une molécule de dichlore (composée de deux atomes de chlore) et une molécule d'eau (composée de deux atomes d'hydrogène et d'un atome d'oxygène).
I.3. Au niveau atomique ...
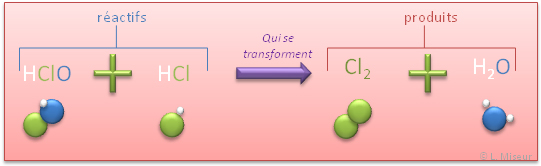
Voyons maintenant ce qu'il se passe au niveau des atomes et des molécules lors d'une réaction chimique, nous avons choisi de représenter les atomes par des boules de couleurs.
La flèche de réaction signifie bien qu'il y a une transformation, que les réactifs se transforment en produits et que donc les atomes et molécules se réorganisent durant une réaction chimique.
Une réaction chimique est une transformation des réactifs au cours de laquelle les atomes se réorganisent pour former les produits.
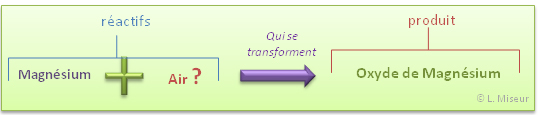
II.1. La combustion du magnésium dans l'air
Expérience : combustion du magnésium dans l'air
Au départ : magnésium (ruban) et air
Après réaction : poudre blanche
Question Mais est-ce vraiment l'air qui réagit dans cette réaction ?
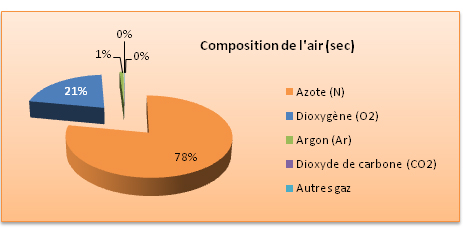
L'air est un mélange plus ou moins homogène de différents gaz (corps purs). Voici la composition type de l'air sec (dont on a enlevé la vapeur d'eau).
Nous savons que l'air est composé de 78% d'azote (N) et de 21% de dioxygène (O2). Un des gaz composant l'air réagit avec le magnésium.
Que pouvons-nous mettre en place afin de mettre cela en évidence ?
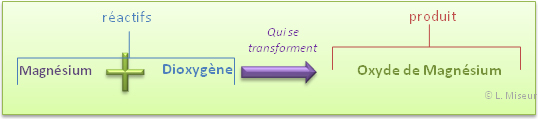
II.2. Combustion du magnésium dans le dioxygène (O2)
Expérience : Combustion du magnésium dans le dioxygène pur
Au départ : magnésium (ruban) et dioxygène
Après réaction : poudre blanche (oxyde de magnésium)
On remarque que la réaction est bien plus intense dans le dioxygène, c'est donc bien avec cette partie de l'air que réagit le magnésium lors de la combustion. De manière générale, une réaction de combustion est une réaction dans laquelle le dioxygène réagit avec une autre substance.
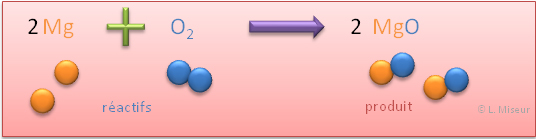
Donnons maintenant l'équation sous forme de formules chimiques :
Et observons ce qu'il se passe au niveau des atomes lors de cette réaction de combustion :
Pendant la réaction, les atomes des réactifs se réorganisent afin de former les produits
II.3. Proportions et réactions chimiques
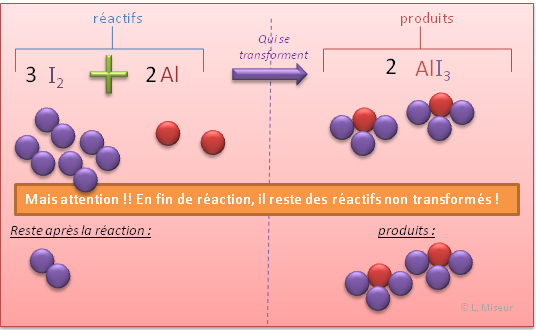
Les réactions chimiques respectent des règles de proportions strictes. Si les réactifs ne sont pas introduits selon les proportions adéquates, seul une partie du réactif présent en trop grande quantité réagira. Il restera donc une quantité du réactif en excès qui n'a pas réagit. Réalisons une expérience au cours de laquelle nous avons volontairement mis trop de diiode.
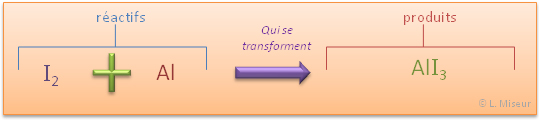
Expérience : réaction du diiode avec de l'aluminium
Parfois, le simple fait de mettre en présence les réactifs ne suffit pas à démarrer la réaction, il faut apporter une "aide". C'est le cas ici avec le magnésium, qui fournit la chaleur nécessaire pour que la réaction débute.
Nous observons pendant la réaction que des fumées violettes se dégagent. Le produit (AlI3) est solide. Le diiode (I2) lorsqu'on le chauffe se sublime et passe directement de l'état solide à l'état gazeux. Grâce à ses informations, nous pouvons dire que le diiode qui n'a pas réagi se retrouve sous forme de fumée violette. Représentons cela au niveau atomique :
III. Réactions incomplètes
Les réactions ne sont pas toujours complètes et parfois, tous les réactifs ne sont pas transformés en produits. Il reste donc une quantité de chacun des réactifs qui n'a pas réagit. Ces réactions sont appelées également réactions équilibrées.
Les solutions contenues dans les berlins ci-contre ont la même concentration molaire, (0,1 M). La solution incolore est une solution de KSCN
La solution orangée/jaune est une solution de FeCl3
Mettons maintenant à l'aide d'une pipette jaugée la même quantité de réactifs dans une éprouvette contenant de l'eau distillée et observons. Nous observons un changement de couleur, ce qui indique qu'une réaction s'est opérée. Redistribuons maintenant le contenu de ce berlin dans 3 petits berlins. Dans l'un rajoutons du KSCN, dans un autre, rajoutons du FeCl3 et observons par-rapport au témoin les changements éventuels.
*
*
*
*
En rajoutant du KSCN, l'on observe que la couleur devient plus intense, il y a donc encore réaction. En rajoutant du FeCl3, l'on observe que la couleur devient plus intense, il y a donc encore réaction. Berlin témoin dans lequel rien n'a été rajouté; (*) les couleurs ne correspondent pas exactement à la réalité.
Si lorsque l'on rajoute l'un ou l'autre des deux réactifs de départ, la coloration change, c'est qu'il reste encore de l'autre réactif dans la solution. Ce qui signifie que dans une réaction incomplète aucun des réactifs n'est épuisé totalement.
voici comment se note la réaction : FeCl3 + KSCN
FeSCN2+ + KCl + 2Cl-
Autres exemples de réactions équilibrées :
- synthèse de l'ammoniac
N
2 (g) + 3 H2 (g)2 NH3 (g)
Fixation de l'oxygène sur l'hémoglobine (symbolisée par Hb) (réaction biochimique).
Hb + O
2HbO2.
IV. Une réaction (très) particulière
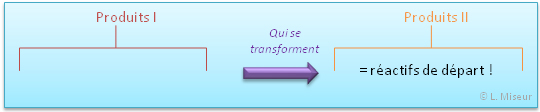
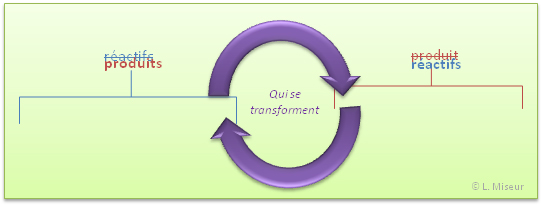
Cette réaction est particulière, car elle n'est pas à sens unique. En effet, les produits obtenus se retransforment en réactifs ! Et la réaction recommence.
Le sens de la flèche permet d'indiquer le sens dans lequel la transformation se fait, mais il est toujours possible qu'une autre réaction se produise à partir des produits obtenus. Et dans ce cas très particulier, la réaction des produits 'I' donne des produits "II" qui sont en fait les réactifs de départ !! La réaction est donc cyclique. On appelle cela une réaction oscillante.
Réservé à une utilisation strictement privée-tous droits de reproduction et de diffusion réservés - (c) L. Miseur - La chimie.net 2010
|
Copyright (c) 2000 - 2023 | Miseur Ludovic | www.lachimie.net | tous droits réservés | remis à jour le : 06/07/2023 |
|
|
|
Comment citer cette page : |
| Miseur, L. (2023). Lachimie.net - La réaction chimique. La Chimie.net. http://www.lachimie.net | |
|
|