Le tableau périodique et Mendeleïev
Le tableau périodique des éléments, appelé aussi parfois Tableau de Mendeleïev * regroupe les différents éléments en les classant selon leurs propriétés et leurs caractéristiques. En voici l'origine :
I. L'histoire du tableau périodique et la classification de Mendeleïev :
|
Dès le début du 19ème siècle, la nécessité de pouvoir classer les éléments chimiques apparait, car ceux-ci deviennent de plus en plus nombreux. La découverte de nouvelles substances et de nouveaux éléments pousse les scientifique à essayer de les regrouper. Les chimistes arrivent à mettre en évidence que toutes les substances contiennent un nombre restreint d'éléments chimiques, qui servent de briques de constructions pour élaborer ces substances. Lothar Meyer, est l'un des premier à proposer un premier système de classification, en 1864. Il a classé les éléments en les regroupant selon le nombre maximum de liaison que chaque élément peut réaliser. Ce système était basé sur 28 éléments seulement, et ne permettait pas de prédire l'existence d'autres éléments et d'en deviner certaines propriétés (comme la masse, l'état physique, ...) Dimitri Mendeleïv tenta de classer les éléments selon certaines de leurs propriétés. il a observé que les propriétés réapparaissaient de façon périodique lorsqu'il classait les éléments par masse croissante. A chaque retour d'une propriété, Mendeleïev indiquait celui-ci dans une autre ligne d'un tableau. La première version du tableau périodique qu'il proposa comportait 5 colonnes et 18 lignes (son tableau était vertical par-rapport à la version moderne). Son génie fût de laisser des cases vides dans son tableau lorsqu'un élément ne présentait pas les propriétés attendues. Il prédit ainsi l'existence d'autres éléments ayant des propriétés semblables aux autres de son groupe. |
En 1913, la classification évolua une dernière fois. On s'aperçut que si l'on tient compte des propriétés chimiques des éléments naturels, les éléments ne doivent pas être classés selon leurs masses atomiques mais selon leurs numéros atomiques (nombre de protons de l'élément). C'est donc le nombre de protons qui détermine la nature de l'élément et une partie de ses propriétés.
II. Le tableau périodique des éléments
II.1. Structure générale
Il est composé de 18 colonnes numérotées de 1 à 18 contenant des cases. (Un ancien système de notation est encore d'usage utilisant les chiffres romains et les lettres A et B). Chaque colonne correspond à une famille d'éléments présentés dans des cases. Un nom est attribué à certains groupes (famille). Les éléments d'une même colonne ont tendance à avoir le même type de comportement (de réactivité).
groupe 1 : Alcalins
groupe 2 : Alcalino-terreux
groupe 13 : Terreux
groupe 14 : Carbonides
groupe 15 : Pnictogènes
groupe 16 : Chalcogènes
groupe 17 : Halogènes
groupe 18 : Gaz rares
Le tableau se compose horizontalement de 7 lignes. Elles sont appelées périodes et correspondent aux différentes couches présentées dans le modèle atomique de Bohr. Les périodes n'ont pas de nom spécifique, mise à part une portion de la période 6 (éléments 57 à 71) qui porte le nom de Lanthanides (nom tiré du premier élément de cette série) et les éléments 89 à 103 de la période 7 appelés Actinides (pour les mêmes raisons).
1
1
H
1.008numéro atomique
Symbole
masse atomique relative (Ar)
2
He
4.00262
3
Li
6.9414
Be
9.01225
B
10.8116
C
127
N
14.0078
O
15.99949
F
18.99810
Ne
20.1803
11
Na
22.989812
Mg
24.305
13
Al
26.98214
Si
28.08615
P
30.97416
S
32.06517
Cl
35.45318
Ar
39.9484
19
K
39.09820
Ca
40.07821
Sc
44.95622
Ti
47.86723
V
50.9424
Cr
52.025
Mn
55.026
Fe
55.84527
Co
58.93328
Ni
58.69329
Cu
63.54630
Zn
65.3831
Ga
69.72332
Ge
72.6433
As
74.92234
Se
78.9635
Br
79.90436
Kr
83.7985
37
Rb
85.46838
Sr
87.6239
Y
88.90640
Zr
91.22441
Nb
92.90642
Mo
95.9643
Tc
98.906244
Ru
101.0745
Rh
102.9146
Pd
106.4247
Ag
107.8748
Cd
112.4149
In
114.8250
Sn
118.7151
Sb
121.7652
Te
127.6053
I
126.9054
Xe
131.296
55
Cs
132.9156
Ba
137.3357-71
72
Hf
178.4973
Ta
180.9574
W
184.075
Re
186.2176
Os
190.2377
Ir
192.2278
Pt
195.0879
Au
196.9780
Hg
200.5981
Tl
204.3882
Pb
207.283
Bi
208.9884
Po
(209)85
At
(210)86
Rn
(222)7
87
Fr
(223)88
Ra
226.02589-103
104
Rf
(261)105
Db
(282)106
Sg
(283)107
Bh
(262)108
Hs
(265)109
Mt
(266)110
Ds
-111
Rg
-112
Cn
-

6
lanthanides
57
La
138.9158
Ce
140.1259
Pr
140.9160
Nd
144.2461
Pm
-62
Sm
150.3663
Eu
151.9664
Gd
157.2565
Tb
158.9366
Dy
162.5067
Ho
164.9368
Er
167.2669
Tm
168.9370
Yb
173.0571
Lu
174.977
actinides
89
Ac
(227)90
Th
232.0491
Pa
231.0492
U
238.0393
Np
237.04894
Pu
(242)95
Am
(243)96
Cm
(247)97
Bk
(247)98
Cf
(249)99
Es
(254)100
Fm
(253)101
Md
(256)102
No
(254)103
Lr
(257)
D'après la dernière version publiée par la IUPAC (22/06/2007) | réactualisé avec la désignation de l'élément 112, le 11/05
II.2. Les cases du tableau périodique
1. Légende :
en haut à gauche : le numéro atomique au milieu : le symbole de l'élément en bas, centré : la masse atomique relative de l'élément
Quelques moyens mnémotechniques :
Connaître la tableau périodique des éléments par cœur n'est pas d'une grande utilité. Toutefois, quelques trucs et astuces existent afin de mémoriser celui-ci. Voici quelques exemples : * période 2 :
Li Be B C N O F Ne Lili Becta Bien Chez Notre Oncle Ferdinant Nestor
* période 3 :
Na Mg Al Si P S Cl Ar Napoléon Mangea Allégrement Six Poulets Sans Claquer d' Argent
D'autres trucs sont disponible sur wikipédia : http://fr.wikibooks.org/wiki/Liste_de_mn%C3%A9moniques#Tableau_p.C3.A9riodique_des_.C3.A9l.C3.A9ments
2. Le numéro atomique (Z) :
Dans le tableau périodique, on peut observer qu'un nombre est inscrit dans le coin supérieur gauche de la case. Il s'agit du numéro atomique Z de l'atome. Ce nombre indique l'ordre de classement de l'atome dans le tableau, mais aussi le nombre de protons (charges positives) de l'atome et par conséquent le nombre d'électrons (charges négatives) de celui-ci, car l'atome est électriquement neutre.
exemple : L'atome d'hydrogène a le numéro atomique 1, ce qui signifie qu'il est le premier atome par ordre de complexité, qu'il possède un proton dans son noyau et un électron périphérique.
3. La masse atomique relative :
Celle-ci est indiquée également dans le tableau périodique, elle se trouve en dessous du symbole de l'élément, ainsi la masse atomique relative (qui se note Ar) de l'atome d'hydrogène est Ar = 1,0079 d'après ce tableau.
4. Synthèse :
Remplace les différents éléments qui constitue une case du tableau périodique.
Les colonnes du tableau périodique sont appelées familles et regroupent des éléments aux propriétés ressemblantes, les lignes horizontales sont appelées périodes.
Dans ce cours nous utiliserons non pas un tableau périodique version papier, mais un tableau interactif. Pour afficher les informations sur l'élément voulu, il suffit de cliquer dessus, et instantanément les informations le concernant apparaissent.
![]() Les
masses
atomiques relatives
Les
masses
atomiques relatives
Quel est la masse atomique relative des éléments suivants (2 décimales) ? (en regardant dans le tableau ci-dessus, version interactive.)
| 1. Phosphore (P) : Ar = | 2. Calcium (Ca): Ar = |
| 3. Cuivre (Cu) : Ar = | 4. Mercure (Hg): Ar = |
| 5. Carbone (C) : Ar = |
![]()
II.3. Exercices
![]()
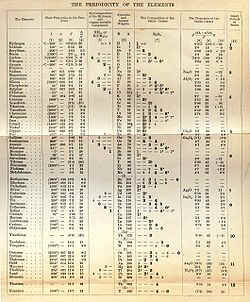
III. Illustrations de la périodicité des propriétés
La périodicité des propriétés physique ou chimique au sein du tableau périodique des éléments peut être observée de façon très visuelle lorsque celles-ci sont représentées sous forme graphique. Observer les évolutions au sein des périodes et la similitude de comportement entre les éléments d'une même famille.
Il est intéressant de comparer les masses volumiques, points de fusion et d'ébullition des différents éléments afin de se rendre compte de la réelle évolution périodique des propriétés. Nous pouvons alors mettre en évidence la grande ingéniosité du système de classement choisi !

|
Copyright (c) 2000 - 2023 | Miseur Ludovic | www.lachimie.net | tous droits réservés | remis à jour le : 06/07/2023 |
|
|
|
Comment citer cette page : |
| Miseur, L. (2023). Lachimie.net - Tableau périodique. La Chimie.net. http://www.lachimie.net | |
|
|