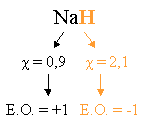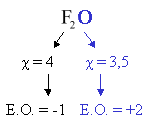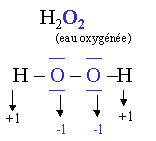Réaction d'oxydoréduction ; nombre ou étage d'oxydation
I. Définition :
Le nombre d'oxydation est une charge fictive attribuée à un élément.
L'étage d'oxydation positif ou négatif correspond au nombre d'électrons perdus ou captés ou partiellement perdus ou captés par un élément par-rapport à son état fondamental (tel qu'il se trouve dans le tableau périodique).
II. Détermination de l'étage d'oxydation :
II.1. d'un élément :
ex. : O, H, Br, Cl, Na, ... Le nombre d'oxydation d'un élément est toujours nul II.2. d'un élément dans une molécule constituée d'atomes identiques
ex. : O2, H2, Br2, O3, P4, S8, ... Chaque atome de ces molécules a un nombre d'oxydation nul. II.3. d'un élément dans une molécule quelconque
ex. : NaCl H2O Na : +1 | Cl : -1 H : +1 | O = -2 Mg3N2 Dans une molécule, la somme des nombres d'oxydation de tous les éléments est nulle. Mg : +2 | N : -3
remarques :
- L'étage d'oxydation (E.O.) de l'hydrogène (H) est en général égal à +1. Sauf dans H (=0) ; H2 (=0); et dans les hydrures (formule MH ; métal + hydrogène)
exemple d'hydrure :
E.O. de l'oxygène (O) = -2. Sauf dans O (=0) ; O2 (=0) ; O3 (=0); F2O et les peroxydes ( formule : R-OO-R ; où R= H ou une chaîne carbonée).
II.4. d'un éléments dans un ion :
Dans un ion, la somme des étages d'oxydation de tous les éléments est égale à la charge de l'ion. ex: Cu2+ ; E.O. = +2 | Cl- ; E.O. = -1 | SO32- ; E.O = x +3. (-2) = -2 ; x = + 4
III. Nombres d'oxydation possibles de quelques éléments :
(extrait du cours de P. Herbrant | http://www.chez.com/courschimie)
|
Les nombres d'oxydation positifs |
||||||
| +1 | +2 | +3 | +4 | +5 | +6 | +7 |
| Sodium
Potassium Argent Mercure Cuivre Hydrogène Chlore Iode |
Baryum
Zinc Calcium Magnésium Manganèse Cuivre Fer Plomb Mercure Cobalt Nickel |
Fer
Aluminium Chrome Azote Phosphore Chlore |
Manganèse
Soufre Carbone Silicium |
Azote
Phosphore Chlore Iode |
Soufre | Chlore
Iode |
Les éléments en bleu présentent plusieurs nombres d'oxydation.
| Les nombres d'oxydation négatifs | |||
| -1 | -2 | -3 | -4 |
| Fluor
Chlore Brome Iode |
Soufre
Oxygène |
Azote
Phosphore |
Carbone |
IV. Exercices
Afin de déterminer l'étage d'oxydation d'un élément dans une molécule, nous devons résoudre une équation à une inconnue.
|
K2 Cr2 O7 | Déterminer l' E.O. de Cr |
| 2 . ( +1) + 2 x + 7 .( -2) = 0 | x = +6 ; L'E.O. de Cr = +6 dans cette molécule |
|
Cr2 O3 | Déterminer l' E.O. de Cr |
| 2 x + 3 .( -2) = 0 | x = +3 ; L'E.O. de Cr = +3 dans cette molécule |
|
|
 |
|
|
|
Copyright (c) 2000 - 2023 | Miseur Ludovic | www.lachimie.net | tous droits réservés | remis à jour le : 06/07/2023 |
|
|
|
Comment citer cette page : |
| Miseur, L. (2023). Lachimie.net - Etage d'oxydation. La Chimie.net. http://www.lachimie.net | |
|
|