La mole - La masse molaire
I. Qu'est-ce qu'une mole ?
Une mole est une quantité d'atomes OU de molécules.
Un atome, une molécule, c'est quelque chose de microscopique. En prenant une grande quantité d'atomes, une mole, on obtient un ensemble mesurable d'un point de vue macroscopique. Nous pouvons peser, par-exemple, la masse d'une mole de sel de cuisine (NaCl) avec une simple balance alors qu'on ne peut pas peser la masse d'une molécule de NaCl.
Une mole, c'est comme dire : une paire de chaussettes (2 chaussettes); une douzaine d'œufs (12 œufs); une rame de papier (500 feuilles); un quatuor de musiciens (4 musiciens)...
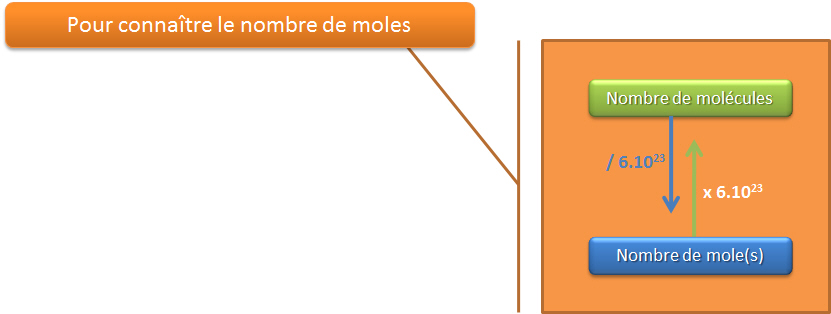
Que vaut une mole ? Dans une mole , il y a 6,02252 . 1023 molécules ou atomes.
Mais on pourrait aussi dire, une mole de grains de riz, ce qui équivaut à prendre 6,02252 . 1023 grains de riz.
Ce nombre particulier, 6,02252 . 1023 a été défini et se note : NA, le nombre d' Avogadro (Nous utiliserons la valeur arrondie à 6. 1023 ).
Voici ce que représente une mole de différentes substances
Comment savoir combien de moles ai-je besoin afin d'effectuer une réaction chimique et dans quelle proportion celle-ci régira-t-elle ?
La réponse à cette question a déjà été donnée par Lavoisier et sa loi de pondération. Les coefficients indiquent le nombre de mole des réactifs qu'il faut mettre en présence pour produire un nombre de mole de produit. Ces coefficients donnent les proportions entre les réactifs et les produits. Tout comme il faut 250 g de beurre, 250 g de lait, 250 g de farine et 250 g d'œufs pour faire 1 gâteau !
Exemple
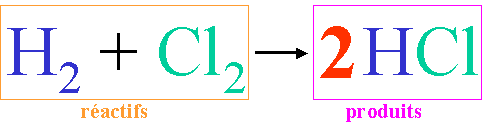
C'est les coefficients qui déterminent le(s) nombre(s) de mole(s). (rappel : pas de chiffre devant une molécule signifie 1 molécule ou 1 mole de molécules).
lecture molaire de l'équation chimique ci-dessus: 1 mole de dihydrogène réagit avec 1 mole de dichlore pour former : 2 moles de chlorure d'hydrogène (2 moles d'acide chlorhydrique).
Ce qui signifie que pour former 2 moles d'HCl, je dois mettre en présence 1 mole de dichlore et 1 mole de dihydrogène. Les proportions sont donc de 1, 1 pour 2
|
|
II. Quelle masse possède une mole de molécules ou d'atomes ?

Par définition, une mole de de 12C (isotope 12 du Carbone) vaut 12g. Et correspond à 6,02252 . 1023 atomes de l'isotope 12 du Carbone.
Donc, pour exprimer la masse d'une mole d'atomes ou de molécules en une mesure connue : le gramme, il suffit de calculer la masse moléculaire relative (ou masse atomique relative) de tous ses composants et d'y rajouter l'unité g.mol-1. Celle-ci signifie bien ...grammes pour 1 mole.
![]() La masse molaire se note
M
.
La masse molaire se note
M
.
Exemple illustré d'utilisation de la masse molaire pour calculer la masse totale de 2 moles de HCl
(H2 : 1 g.mol-1 x 2 mol = 2g de dihydrogène + Cl2 : 35 g.mol-1 x 2 mol = 70 g de dichlore donnent : 2 moles d' HCl soit :( 1g.mol-1 + 35 g.mol-1 ) x 2 mol = 36 g.mol-1 x 2 mol = 72 g ) (rem : la loi de Lavoisier a bien été respectée car la masse des réactifs est égale a la masse des produits.
Dans cet exemple; la masse d'une mole de H2 (Dihydrogène) vaut 2 grammes : H2 : la masse molaire du dihydrogène est de 2 g.mol-1.
![]() La masse molaire
s'exprime en gramme(s) par mole (g.mol-1).
La masse molaire
s'exprime en gramme(s) par mole (g.mol-1).
Rappel des différentes indications concernant la masse des atomes et des molécules :
La masse atomique relative d'un atome, se note Ar et ne possède pas d'unités.
La masse moléculaire relative, se note Mr et ne possède pas d'unités.
La masse molaire, se note M et est exprimée en g.mol-1 que l'on peut noter aussi g/mole.
Exercices
![]()
III. Application - Détermination expérimentale d'une formule chimique.
Il est souvent demandé aux chimistes
d'identifier une série de substances et d'en donner les composants. Une première
approche est l'analyse élémentaire du mélange (pouvoir dire quels sont les éléments présents dans le mélange).
Cette analyse permet de connaître les proportions
et la nature des différents éléments contenus dans l'échantillon à analyser
et l'on pourra ensuite tenter d'en déduire les molécules dont il est composé.
-
analyse échantillon A
| Elément | Zn | O | S |
| % en masse | 40,5 | 39,6 | 13,9 |
| nombre de gramme dans 100 grammes d'échantillon | 40,5 | 39,6 | 13,9 |
| nombre de moles | 40,5/65.4(=
M
Zn)
0,62 mol |
39,6/16 (=
M
O)
2,245 mol |
13,9/32 = (
M
S)
0,62 mol |
| proportions (nombres entiers) | 1 | 4 | 1 |
| molécule probable | ZnSO4 | ||
-
analyse échantillon B
| Elément | K | Cr | O |
| % en masse | 26.6 | 35.4 | 38 |
| nombre de gramme dans 100 grammes d'échantillon | 26.6 | 35.4 | 38 |
| nombre de moles | 26.6/39.1
0.68 |
35.4/52
0.68 |
38/16
2.375 |
| proportions (nombres entiers) | 2 | 2 | 7 |
| molécule probable | K2Cr2O7 | ||
|
|
|
| |||||||||
|
Copyright (c) 2000 - 2023 | Miseur Ludovic | www.lachimie.net | tous droits réservés | remis à jour le : 06/07/2023 |
|
|
|
Comment citer cette page : |
| Miseur, L. (2023). Lachimie.net - La mole. La Chimie.net. http://www.lachimie.net | |
|
|





