Les ions
I. Les espèces chargées
I.1. Mise en évidence
Observe les étiquettes ci-dessous, repère les différents éléments présents dans cette eau.
Tu auras identifié plusieurs éléments chimiques et symboles déjà connus ... Mais il y a une différence avec les symboles déjà vus !
A côté des symboles des éléments chimiques contenus dans cette eau, apparaît un signe mathématique en exposant (+ ou -). Cela signifie donc que ce ne sont pas les éléments neutres qui sont présents dans cette eau, mais des particules chargées qui ont les mêmes propriétés chimiques que les éléments neutres. Nous avons déjà vu que dans un élément chimique, le nombre de protons (particules positives formant le noyau) et le nombre d'électrons (particules négatives gravitant autour du noyau) est identique. Dans les espèces chargées, les IONS, ces nombres de protons et d'électrons sont différents.
/!\ Les ions sont formés suite à un ajout ou un retrait d'électrons ! Les protons sont liés dans le noyau par des attractions très fortes et lorsque l'on forme un ion, on ne modifie JAMAIS le nombre de protons présents dans le noyau. (Pour rappel, c'est le nombre de protons contenus dans le noyau qui détermine l'élément !)
I.2. Expérience
Nous avons observé qu'il a donc des espèces chargées dans l'eau. Montrons maintenant que ces ions sont de deux types : soit chargés positivement (plus de protons que d'électrons), soit négativement (plus d'électrons que de protons).
Pour ce faire, nous allons faire passer un courant électrique dans une solution de CuSO4 (sulfate de cuivre) et de K2Cr2O7 (dichromate de potassium).
Dans un tube en U rempli d'une solution conductrice (H2SO4 0,5 mol.L-1), l'on introduit le mélange d'ions et l'on place ensuite deux électrodes de graphite (carbone - comme la mine de ton crayon !). On fait passer un courant électrique dans la solution via les électrodes (une électrode est un matériau qui permet le passage du courant). Nous avons donc une électrode positive et une négative.
- Après 20 minutes, on observe que les ions se sont séparés aux deux électrodes. L'une montrant une couleur bleue, l'autre orange.
- Il y a donc bien deux types d'ions différents.
II. Définitions
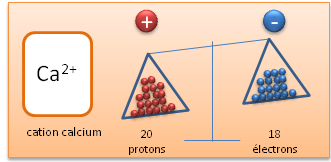
II.1. Cation
Un cation est un ion chargé positivement, ce qui signifie que par-rapport à l'atome neutre, il possède moins d'électrons.
Atome neutre (élément)
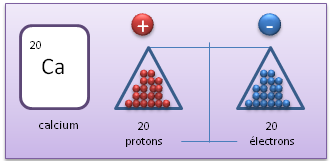
Cation (Calcium avec un défaut d'électrons par-rapport à l'atome neutre)
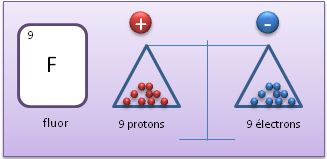
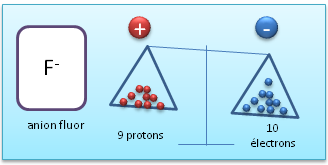
II.2. Anion
Un anion est un ion chargé négativement, ce qui signifie que par-rapport à l'atome neutre, il possède plus d'électrons.
Atome neutre (élément)
Anion (Fluor avec un électron en plus par-rapport à l'atome neutre)
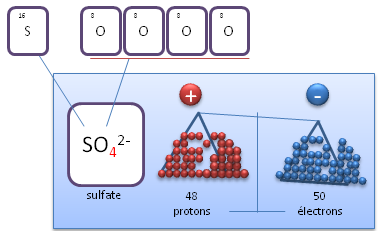
II.3. Ions polyatomiques
Un ion polyatomique est un ion constitué de plusieurs (poly) atomes. Le nombre de protons correspond à la somme des protons des atomes présents au sein de l'ion polyatomique et sa charge est définie par le nombre d'électrons total présents. Exemple : l'ion sulfate est chargé 2-, ce qui signifie qu'il possède deux électrons de plus que le nombre de protons total.
III. Appliquons la théorie
IV. Test d'identification des ions en solution
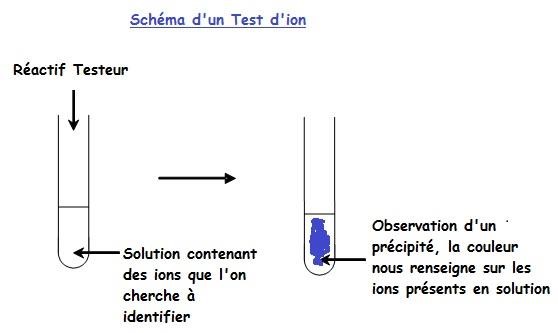
Il existe des tests de reconnaissance d’ions faisant appel à des réactions chimiques simples qui donnent des produits solides colorés facilement identifiables dans une solution.
Mode opératoire
Introduire dans un tube à essai quelques mL de solution contenant des ions que l'on cherche à identifier.
Dans ce tube, introduire quelques gouttes de réactif testeur.
Interprétation des résultats
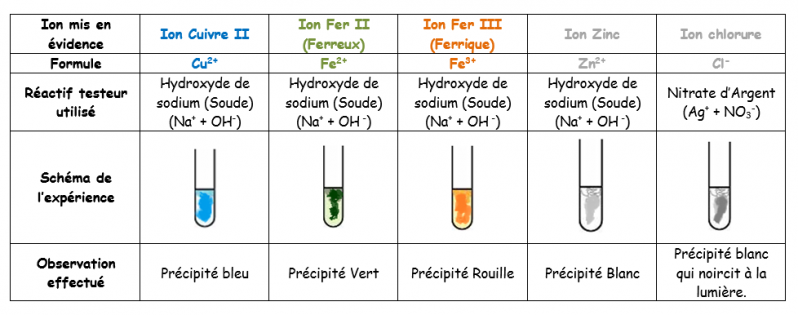
==> Test de reconnaissance des ions Cuivre (Cu2+) : Réactif utilisé la Soude (Hydroxyde de sodium)
En présence de soude, les ions Cu2+ forment un précipité bleu.
==> Test de reconnaissance des ions Zinc (Zn2+): Réactif utilisé la Soude (Hydroxyde de sodium)
En présence de soude, les ions Zn2+ forment un précipité blanc. Si on met beaucoup de soude, ce précipité se dissout et la solution redevient incolore
==> Test de reconnaissance des ions Fer II (Fe2+): Réactif utilisé la Soude (Hydroxyde de sodium)
En présence de soude, les ions Fe2+ forment un précipité vert.
==> Test de reconnaissance des ions Fer III (Fe3+): Réactif utilisé la Soude (Hydroxyde de sodium)
En présence de soude, les ions Fe3+ forment un précipité rouille.
==> Test de reconnaissance des ions Chlorure Cl-: Réactif utilisé le Nitrate d’argent.
En présence de nitrate d’argent, les ions Cl- forment un précipité blanc qui noircit à la lumière.
Résultats expérimentaux
© Labruyere Xavier - Test Identification des ions, [en ligne], http://sciencesphysiques.e-monsite.com/pages/fiches-methodes/test-identification-des-ions.html - Avec son aimable autorisation.
Exercices
![]()
V. Exercices
![]()
![]()
![]()
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||
|
Copyright (c) 2000 - 2023 | Miseur Ludovic | www.lachimie.net | tous droits réservés | remis à jour le : 06/07/2023 |
|
|
|
Comment citer cette page : |
| Miseur, L. (2023). Lachimie.net - Les ions. La Chimie.net. http://www.lachimie.net | |
|
|