La valence
Les molécules sont des associations d'atomes. Ces associations ne se font pas n'importe comment, elles se font selon des règles précises, dont la valence.
I. Electrolyse de l'eau
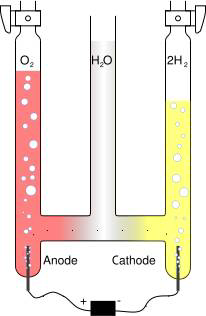
Grâce à une source de courant électrique, nous allons décomposer
des molécules d'eau en leurs constituants de base : De l'Oxygène et de l'Hydrogène. Ces deux éléments se combinent alors entre eux pour former des associations plus stables ; les molécules de Dioxygène (O2) et les molécules de Dihydrogène (H2).
Nous allons mettre en place un dispositif qui va séparer l'eau en ces constituants, pour ce faire, nous utilisons une verrerie spéciale composée de tubes reliés entre eux. Les deux tubes externes se composent à leur base d'une électrode, qui permet l'apport de courant à la solution et aux extrémités d'un bouchon qui permet d'évacuer les produits gazeux formés.
Au début de l'expérience, on observe après mit en route du courant, la formation de bulles aux électrodes. Ces bulles montent alors dans les tubes et l'eau diminue laissant la place aux gaz formés.
On observe après quelques minutes que les hauteurs d'eau dans les deux tubes sont différentes. Dans le tube de droite l'eau est descendue deux fois plus bas que dans celui de gauche. Un gaz a donc été formé en quantité
double
de l'autre.
On récolte ensuite dans des éprouvettes un peu de gaz de chaque tube. Dans un cas, lorsque l'on approche une allumette de l'éprouvette, on entend un bruit de détonation et dans l'autre cas, lorsque l'on approche une allumette presque éteinte, on observe que celle-ci se rallume avec une belle flamme.

Sachant que :
- Une des propriétés du dihydrogène est d'être un gaz facilement inflammable, qui fait un bruit caractéristique au contact du feu.
- Une des propriétés du dioxygène est d'être un gaz comburant, ce qui signifie qu'il a la propriété de réactiver un feu.
L'on peut en conclure, que nous avons formé à partir de molécules d'eau, du dihydrogène et du dioxygène. Si l'on observe les tubes d'où proviennent les gaz, on remarque que l'on a formé 2 fois plus de dihydrogène que de dioxygène.
Conclusion : Il y a dans les molécules d'eau 2 fois plus d'hydrogène que d'oxygène : Cela correspond bien à la formule chimique : H2O, déjà bien connue !
<>
Voyons maintenant, comment savoir quelles sont les quantités d’éléments présents au sein d'autres molécules. Pour cela nous aurons besoin du concept de valence.
II. La valence
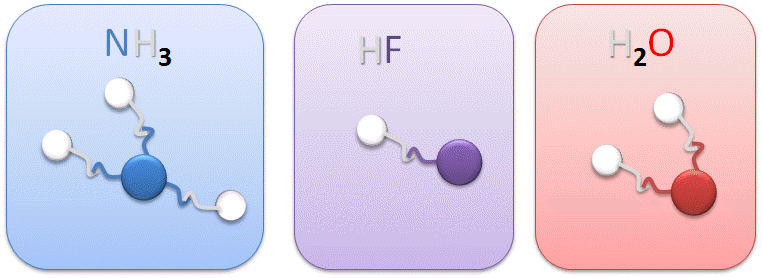
II.1. Quelques molécules courantes :
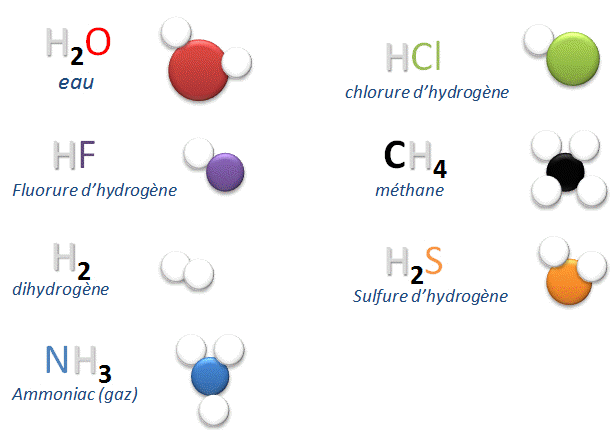
II.2. Définition :
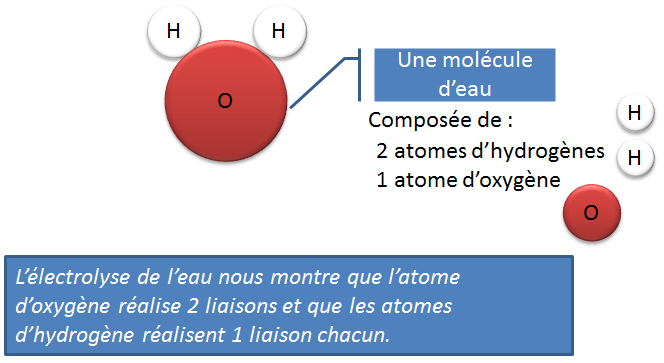
La valence d'un atome (élément, ou groupement) est la capacité de liaison de cet atome avec l'hydrogène. Autrement, dit, c'est le nombre d'atomes d'hydrogène maximal avec lequel un atome peut se lier.Par définition, l'atome d'hydrogène possède toujours 1 seul site de liaison (1 crochet). Pour les atomes courants, cette règle peut être étendue aux autres atomes que l'hydrogène et donc donner le nombre de "crochets" que possède un atome pour se lier à d'autres et former des molécules.
Dans le cas de la molécule d'eau (H2O); l'oxygène possède deux sites de liaison (2 crochets) ! Il est donc possible de lier 2 atomes d'hydrogène à l'oxygène, sa valence sera II.
II.3. Quelles sont les valences ?
Pour connaître la valence d'un élément, il faut regarder le tableau de périodique. On aperçoit au passage que les symboles ne sont pas disposés n'importe comment mais dans des colonnes avec à leur tête des chiffres romains. Les tableaux récents suivent la nouvelle recommandation et indique les groupes de 1 à 18. La notation en chiffre romain sera probablement bientôt abandonnée.
Chaque colonne désigne une famille ou plutôt un groupe. Voici pour chaque groupe la valence correspondante :
| Ia | IIa | IIIa | IVa | Va | VIa | VIIa | VIIIa | |
| groupe | 1 | 2 | 13 | 14 | 15 | 16 | 17 | 18 |
| valence associée | I | II | III | IV | III | II | I | 0 |
| valence | I | II | III | IV | III | II | I | - | ||||||||||
| n° colonne | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
1 | 1 H | 2 He | ||||||||||||||||
2 | 3 Li | 4 Be | 5 B | 6 C | 7 N | 8 O | 9 F | 10 Ne | ||||||||||
3 | 11 Na | 12 Mg |
| 13 Al | 14 Si | 15 P | 16 S | 17 Cl | 18 Ar | |||||||||
4 | 19 K | 20 Ca | 21 Sc | 22 Ti | 23 V | 24 Cr | 25 Mn | 26 Fe | 27 Co | 28 Ni | 29 Cu | 30
Zn | 31 Ga | 32 Ge | 33 As | 34 Se | 35 Br | 36 Kr |
5 | 37 Rb | 38 Sr | 39 Y | 40 Zr | 41 Nb | 42 Mo | 43 Tc | 44 Ru | 45 Rh | 46 Pd | 47 Ag | 48 Cd | 49 In | 50 Sn | 51 Sb | 52 Te |
53 I | 54 Xe |
6 | 55 Cs | 56 Ba | 57-71 | 72 Hf | 73 Ta | 74 W | 75 Re | 76 Os | 77 Ir | 78 Pt | 79 Au | 80 Hg | 81 Tl | 82 Pb | 83 Bi | 84 Po | 85 At | 86 Rn |
7
| 87 Fr | 88 Ra |
89-103 | 104
Rf | 105 Db | 106 Sg | 107 Bh | 108 Hs | 109 Mt | 110 Ds | 111 Rg | 112 Cn |
|
|
|
|
|
|
site de liaison 1 2 3 4 5 6 7 0
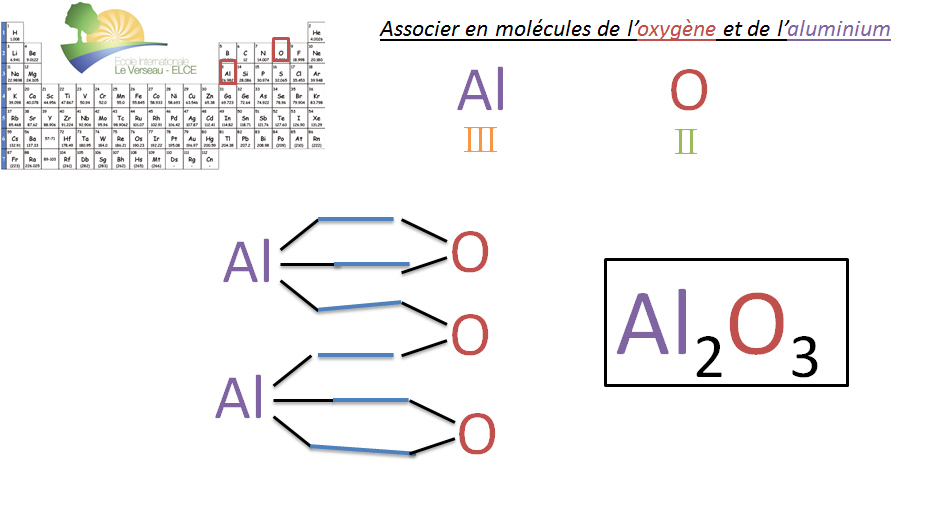
II.4. Construction de molécules avec l'aide des valences
Règle du CHIASME
Pour trouver les indices et donc le nombre d'atomes correct lors de la formation d'une molécule, il suffit d'inverser les valences des éléments. Cette inversion permet de donner l'indice de chaque atome. (!! Certains groupements d'atomes ont une valence particulière qui sera vue au thème suivant).
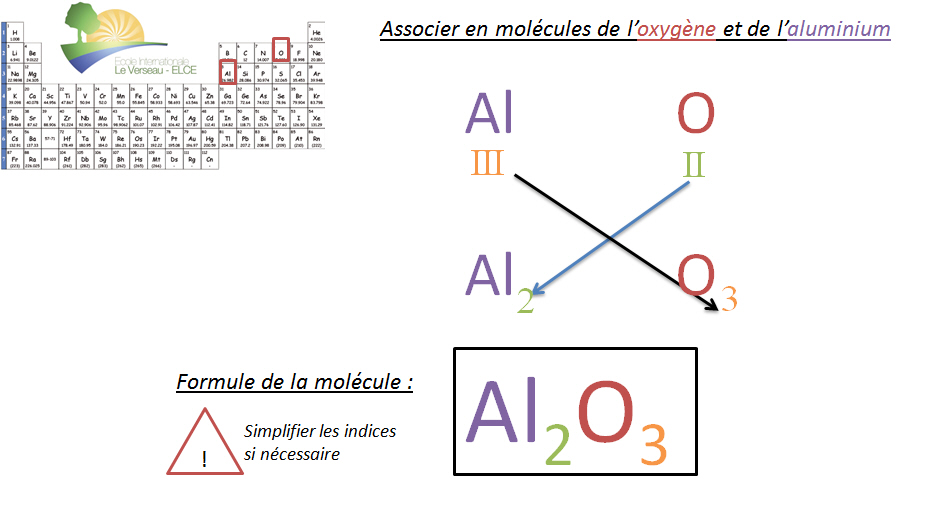
Autres exemples :
NH3 : La valence de l'azote (N) est III, ce qui signifie que l'azote est capable de se lier à 3 hydrogènes
Li OH : La valence du lithium (Li) est I, ce qui signifie que le lithium est capable de se lier à 1 hydrogène. La valence du groupement "OH", le groupement hydroxyde est également I. Ce qui signifie que l'on peu lier 1 hydrogène à ce groupement.
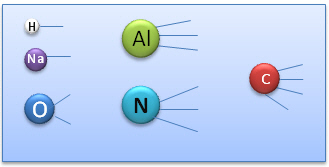
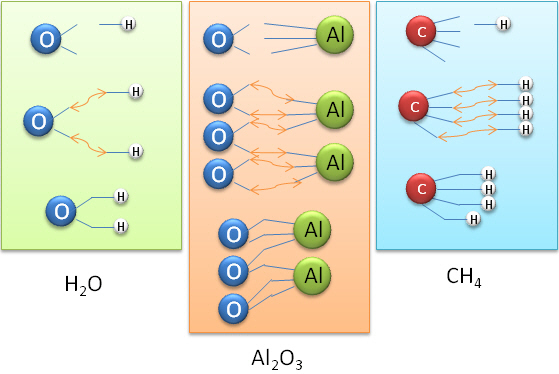
La méthode des bras de valence
Cette méthode consiste à représenter les différents "bras" ou sites de liaisons que possède un atome selon sa valence. (Cette méthode ne tient pas compte de l'organisation dans l'espace des sites).
Ainsi, l'on peut représenter les éléments avec leurs différents sites de liaisons :
Il devient alors possible de construire des molécules en veillant à ce que les différents sites des atomes soient liés.
Une règle :
La valence des éléments s'indique toujours en chiffres ROMAINS
Remarque : La méthode des valences constitue un moyen de former des molécules simples. Cette technique devrait toutefois rester réservée à la formation de molécules avec l'hydrogène (si l'on veut rester fidèle à la définition). Il existe d'autres règles qui régissent la formation des molécules et la liaison d'atomes. Toutefois, cette règle nous permet de commencer la construction des premières molécules chimiques.
|
|
III. Valences particulières
Voici la valence de certains éléments des colonnes B (groupes 3 à 13), ils ont souvent plusieurs valences.
- Retenons ceux-ci :
| I | II | III | IV |
|
Ag |
|||
| Zn | |||
| Cu | Cu | ||
| Pb | Pb | ||
| Fe | Fe |
Il y a également des groupements pour lesquels une valence particulière a été attribuée.
Définition
Un groupement est un ensemble d'atome qui se comporte comme si il ne s'agissait que d'un seul atome. Un groupement possède sa propre valence.
| I | II | III | ||||||
| Forme ionique | Forme moléculaire | nom | Forme ionique | Forme moléculaire | nom | Forme ionique | Forme moléculaire | nom |
| NH4+ | KNH4 | Ammonium |
CO32- |
K2CO3 | Carbonate | PO33- | K3PO3 | Phosphite |
| OH- | KOH | Hydroxyde | SO32- | K2SO3 | Sulfite | PO43- | K3PO4 | Phosphate |
| NO2- | KNO2 | Nitrite | SO42- | K2SO4 | Sulfate | |||
| NO3- | KNO3 | Nitrate | ||||||
| ClO- | KClO | Hypochlorite | ||||||
| ClO2- | KClO2 |
Chlorite |
||||||
| ClO3- | KClO3 | Chlorate | ||||||
| ClO4- | KClO4 | Perchlorate | ||||||
| MnO4- | KMnO4 | Permanganate | ||||||
|
| |||||||||
|
Copyright (c) 2000 - 2023 | Miseur Ludovic | www.lachimie.net | tous droits réservés | remis à jour le : 06/07/2023 |
|
|
|
Comment citer cette page : |
| Miseur, L. (2023). Lachimie.net - La valence. La Chimie.net. http://www.lachimie.net | |
|
|