Isomérie (plane)
Des isomères sont des composés qui ont la même formule générale (même nombre d'atomes identiques qui composent les molécules, un peu comme avec un jeu de construction où l'on doit construire le plus de choses différentes à partir de 2 blocs rouges, 5 verts et 4 bleus), mais qui n'ont pas la même formule développée. On dit qu'entre ces composés il y a une relation d'isomérie.
Des substances isomères n'ont pas les mêmes propriétés physiques et/ou chimiques.
La disposition des atomes dans des molécules isomères peut différer de plusieurs façons, ce qui explique l'existence de divers types d'isomérie.
I. Isomérie de position
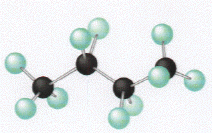
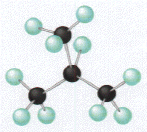
Nous avons vu qu'une molécule peut avoir une chaîne carbonée linéaire, mais elle peut également être ramifiée. Ci-dessous sont représentées deux molécules qui ont un nombre d'atomes de carbone et d'hydrogène identique (elles ont la même formule générale). Ces substances sont appelées isomères, pourtant leurs structures sont différentes.
|
molécule de butane linéaire |
molécule ramifiée (isomère du butane) |
|
|
|
|
butane (C4H10) (4+0) |
méthylpropane (C4H10) (3+1) |
La ramification ne se met jamais sur le premier ou le dernier carbone, car dans ce cas là, il ne s'agit plus d'une chaîne ramifiée, mais d'une chaîne linéaire. En effet; les différents groupements sont en rotation autour de l'axe C - C. Attention également à ne pas représenter trop d'isomères, la molécule peut "se lire" dans les deux sens. Exemple :
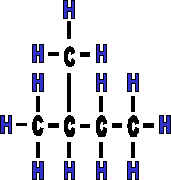 |
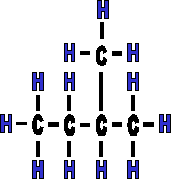 |
|
Il s'agit de la même molécule mais vue d'un autre angle. Elle a subit une rotation de 180°, il ne s'agit donc pas de molécules isomères, mais de molécules identiques. |
|
|
|
Une astuce pour ne pas oublier de représenter des isomères possibles d'une substance : décomposer la molécule de départ en une addition de deux éléments. Exemple avec un octane : (8+0 ; 7+1 ; 6+2 ; 5+3, 4+4), et lorsque la décomposition en vient à additionner les deux même chiffres, mais dans un autre ordre (5+3), stopper celle-ci ! |
Formules développées et semi-développées
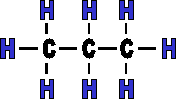
Nous avons toujours représenté les molécules de façon développée, en indiquant chaque atome de carbone et la liaison qui les unit. Afin de permettre une écriture plus rapide, l'on indique la chaîne carbonée et ensuite le nombre d'hydrogène qui se rattachent à chaque atome de carbone. Exemples :
| écriture développée | écriture semi-développée |
|
|
CH3 - CH2 - CH3 |
| CH3 , le premier
carbone, 3 hydrogène sont présents car il reste 3 "places"
disponibles. ( le carbone est de valence IV) CH2, deux hydrogène sont présents sur ce carbone car 2 "places" sont disponibles. |
Lorsqu'il y a des ramifications, l'on peut soit les mettre graphiquement, soit mettre une parenthèse après la formule du carbone sur lequel il se rattache.
soit : 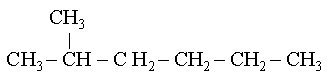
Soit : CH3-CH(CH3)-CH2-CH2-CH2-CH3
![]()
Les isomères de position appartiennent à la même fonction et ne différent que par la position le long de la chaîne d'un atome ou d'un groupe d'atome. Leurs propriétés chimiques sont habituellement voisines, mais leurs propriétés physiques diffèrent (température d'ébullition, densité, ...).
|
Les molécules ci-dessous sont des substance isomère de l'octane (C8H18), vrai ou faux ? |
|
|
II. Isomérie de constitution
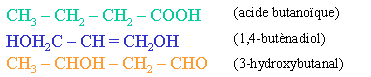
Le seul point commun entre des isomères de constitution est qu'ils possèdent la même formule générale, ainsi pour les trois molécules données en exemple ci-dessus, la formule générale est C4H8O2. Ces isomères n'appartiennent pas à la même fonction (acide; dialcool; aldéhyde-alcool). Leur isomérie résulte d'un "hasard". Ces composés diffèrent au niveau de leurs propriétés chimiques et également au niveau de leurs propriétés physiques (t° d'ébullition différentes, par exemple).
III. Tautomérie
Des composés tautomères, sont des isomères de constitution qui peuvent se transformer de façon réversible l'un en l'autre.
Exemple :
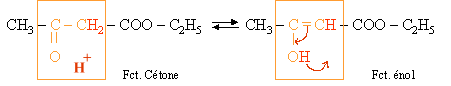
Si l'on fait réagir un mélange de deux formes tautomères "A" et "B" avec un composé réagissant uniquement avec la forme "A", alors les molécules de la forme "B" se transformeront sous la forme de molécules "A". Il s'agit en fait d'un cas d'équilibre chimique (voir la partie chimie minérale).
|
Copyright (c) 2000 - 2023 | Miseur Ludovic | www.lachimie.net | tous droits réservés | remis à jour le : 06/07/2023 |
|
|
|
Comment citer cette page : |
| Miseur, L. (2023). Lachimie.net - cours de chimie et ressources didactiques pour apprendre les savoirs disciplinaires, les savoir-faire et compétences de base des sciences chimiques. La Chimie.net. http://www.lachimie.net | |
|
|