Distinction phénomènes physiques et phénomènes chimiques
Réalisé sur base du cours de M. P. Hebrant (http://courschimie.chez.com) | Avec son aimable autorisation.
I.1. Mise en évidence
Nous allons essayer de mettre en évidence ce qu'est une réaction chimique d'un point de vue macroscopique (c'est à dire dont nous pouvons observer à l'oeil nu certaines caractéristiques).
Pour ce faire, relevons quelques propriétés propres au Fer et au Soufre :
Expérience 1 : comportement dans l'eau
|
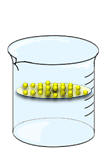
Fer Versons un peu de limaille de fer dans un verre contenant de l'eau. Agitons ... Nous constatons que la limaille se dépose au fond du verre. Le fer est insoluble dans l'eau. |
Soufre Versons un peu de fleur de soufre dans un verre contenant de l'eau. Agitons ... La fleur de soufre flotte sur l'eau. Le soufre est insoluble dans l'eau. |
Expérience 2 : comportement lors de la mise en présence d'un aimant
|
|
I.2.1. Séparation des constituants du mélange
Après la réalisation de ces expériences, réfléchissons aux méthodes que nous pouvons employer pour séparer les constituants d'un mélange fer-soufre

Reprenons la première expérience. Nous savons que ni le fer ni le soufre ne sont solubles dans l'eau. La limaille de fer coule au fond du verre, la fleur de soufre flotte à la surface de l'eau. Nous basant sur cette différence de comportement, nous pouvons à bon droit émettre l'hypothèse que nous pouvons séparer les constituants d'un mélange fer-soufre par flottation et décantation.
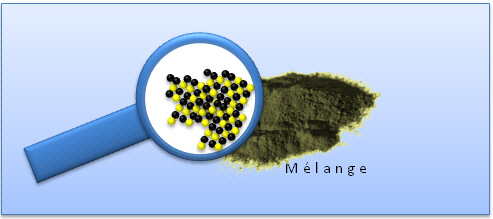
Confrontons notre hypothèse à la réalité grâce à une expérience: dans un tube à essais versons notre mélange fer-soufre (figure a). Versons ensuite de l'eau et agitons. Laissons reposer quelques instants. Nous constatons (figure b) que la fleur de soufre flotte à la surface de l'eau (flottation) et que la limaille de fer tombe au fond du verre (décantation).
|
|
|
|
figure a |
figure b |
Portons maintenant notre attention sur la deuxième expérience (le fer possède des propriétés magnétiques alors que le soufre n'en a pas). Nous sommes naturellement portés à penser que nous pouvons séparer les constituants d'un mélange fer-soufre par aimantation. Un rapide essai nous convainc de la validité de notre hypothèse.
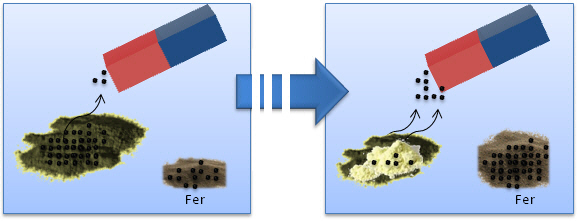 |
Une série d'allers et retours avec l'aimant nous permettent de retirer le fer du mélange, ne laissant dans le verre de montre que le soufre.
I.2.2. Résumé
Nous avons réalisé un mélange de deux substances, le fer et le soufre, dont nous avions préalablement étudié quelques propriétés caractéristiques. Nous basant sur ces propriétés, il nous a été possible de séparer les constituants du mélange fer-soufre en faisant appel à diverses manipulations:
-
la flottation et la décantation;
-
l'aimantation.
A la suite de ces diverses manipulations, le fer et le soufre ont conservé leurs propriétés caractéristiques initiales.
Nous avons donc bien retrouvé nos substances de départ et le fait de réaliser un mélange soufre-fer n'a pas changé leurs propriétés respectives.
II.1. Comment obtenir une nouvelle substance ?
Reprenons notre mélange fer-soufre. Nous allons maintenant nous livrer sur lui à diverses manipulations et en observer le résultat.
Expérience 1
|
Fer |
Soufre |
Mélange fer-soufre |
| Dans un tube à essais, introduisons un peu de limaille de fer. Ajoutons un peu d'acide chlorhydrique. | Dans un tube à essais, introduisons un peu de fleur de soufre. Ajoutons un peu d'acide chlorhydrique. |
Dans un tube à essais contenant du soufre et de l'acide chlorhydrique, introduisons de la limaille de fer. |
|
|
|
|
|
L'acide réagit avec le fer. Il se dégage un gaz explosif: le dihydrogène, incolore et inodore. |
L'acide ne réagit pas avec la fleur de soufre. |
L'acide réagit avec le fer du mélange fer-soufre. Il se dégage un gaz explosif: le dihydrogène, incolore et inodore. |
Expérience 2
|
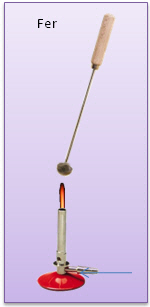
Fer Prélevons un peu de limaille de fer grâce à une cuiller à combustion. Chauffons énergiquement.
Nous obtenons une masse rouge. Après refroidissement, le fer a conservé ses propriétés caractéristiques initiales |
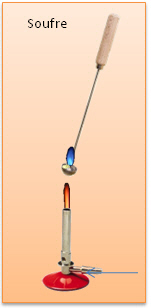
Soufre Prélevons un peu de fleur de soufre grâce à une cuiller à combustion. Chauffons énergiquement.
Le soufre devient liquide, ensuite il brûle avec une flamme bleue. Une odeur piquante se dégage. |
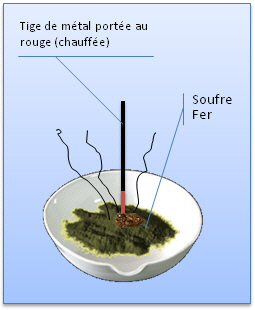
Fer-soufre Versons un peu de mélange fer-soufre dans un creuset. Introduisons dans le mélange une tige métallique portée au rouge. (soit un apport d'énergie sous forme thermique)
Le mélange fer-soufre a changé d'aspect. Il ne montre plus de propriétés magnétiques. Le sulfure de carbone n'a aucun effet. (Le sulfure de carbone est un composé liquide qui dissout le soufre et pas le fer) |
Lors du chauffage du mélange fer-soufre, les propriétés caractéristiques initiales du fer et du soufre ont été perdues. Le solide gris formé est une nouvelle substance. Sous l'effet de la chaleur, le fer et le soufre ont formé du sulfure de fer. Nous écrirons:
|
Fer + Soufre Chaleur |
II.2. Conclusion
Toutes les manipulations que nous avons réalisées depuis le début de ce cours peuvent être classées en deux catégories facilement distinctes:
-
catégorie 1: les manipulations qui conservent aux constituants d'un mélange, ou à une substance, leurs propriétés caractéristiques initiales;
-
catégorie 2: les manipulations qui conduisent à une transformation des constituants d'un mélange, ou d'une substance, avec pour conséquence la perte des propriétés caractéristiques initiales de ceux-ci.
Nous appellerons "phénomènes physiques" les manipulations de la catégorie 1.
Nous appellerons "phénomènes chimiques" les manipulations de la catégorie 2.
Ainsi, nous pouvons écrire:
|
La formation d'un mélange et les opérations de séparation de ses constituants sont des:
phénomènes physiques. Ils ont lieu entre:
|
La transformation fer + soufre en sulfure de fer est un:
phénomène chimique. Il a lieu entre:
|
D'une manière générale, lors de phénomènes physiques la matière ne subit pas de transformations (le fer reste du fer, le soufre reste du soufre).
A l'inverse, lors de phénomènes chimiques la matière subit de profondes transformations (le fer et le soufre se transforment en sulfure de fer).
Quelques exemples de phénomènes physiques ou chimiques dans la vie courante
Voir l'animation Que sont la physique et la chimie ? sur http://www.cea.fr/multimedia/Pages/animations/physique-chimie/que-sont-physique-et-chimie.aspx
Un second critère permet de différencier des phénomènes plus particuliers comme l'émission de lumière par une substance. C'est la quantité d'énergie fournie ou libérée qui détermine le type de phénomène. 
La distinction entre phénomène physique et chimique se fait sur base d'un premier critère que nous avons vu : le changement ou non de nature de la matière.
III. Exercices
![]()
|
| |||||||||
Copyright (c) 2000 - 2023 | Miseur Ludovic | www.lachimie.net |
tous droits réservés | remis à jour le : 06/07/2023
Comment citer cette page :
Miseur, L. (2023). Lachimie.net - physique ou chimique ?. La Chimie.net. http://www.lachimie.net
![]()