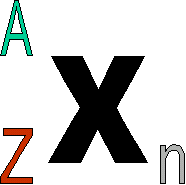Les neutrons
I. Définition
Le neutron ressemble beaucoup au proton: de masse à peu près équivalente, il est néanmoins électriquement neutre.
Neutron et proton forment la famille des nucléons .
Comparons :
Masse d'un proton : mp 1.672 6231 x 10-27 kg
Masse d'un électron : me 9.109 3897 x 10-31 kg
Masse d'un neutron : 1,674 94 × 10-27 kg
Un proton a une masse égale à 0,9986 fois celle d'un neutron. Ces particules ont donc bien des masses équivalentes.
Pour un type d'atome, le nombre de neutrons (noté N ) peut être variable, mais il est en général assez proche du nombre de proton Z, sauf pour les atomes très lourds.
Par exemple, l'uranium naturel existe sous deux formes: son noyau peut avoir 92 protons + 143 ou 146 neutrons.
|
Nombre de protons |
Nombre de neutrons |
isotopes |
|
Z = 92 |
N = 143 |
Uranium U235 |
|
Z = 92 |
N = 146 |
Uranium U238 |
On appelle ces deux variétés d'uranium des isotopes de l'uranium, notés U 235 (car 92 protons + 143 neutrons = 235 nucléons) et U 238 (pour 238 nucléons).
Dans U 235, on appelle 235 le nombre de masse de l'atome, noté A .
A = Z + N
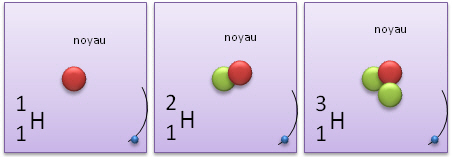
Autre exemple, si l'hydrogène (en plus de son unique proton) possède un ou deux neutrons, il devient un isotope d'hydrogène (baptisé ici deutérium ou tritium ).
|
Nombre de Masse |
Nombre de protons |
Nombre de neutrons |
isotopes |
|
A = 1 |
Z = 1 |
N = 0 |
Hydrogène normal |
|
A = 2 |
Z = 1 |
N = 1 |
Hydrogène
lourd |
|
A = 3 |
Z = 1 |
N = 2 |
Hydrogène hyper
lourd |
|
|
||
|
1H (hydrogène) |
2H (deutérium) |
3H (tritium) |
Voyez l'exemple animé pour le carbone 12 et son isotope le carbone 13:
Notez bien que si vous ajoutez à C, non pas un neutron, mais un proton, vous changez sa nature en un autre atome (ici le carbone C devient azote N):
A noter que certains isotopes d'atomes courants tels le Carbone 14 ou le Potassium 40 sont radioactifs et donc instables. Les atomes radioactifs sont aussi appelés radio éléments .
Notation
Un atome comme le carbone est noté symboliquement 126C avec A=12 et Z=6.
Son isotope, le carbone 14, se notera donc 146C.

II. Détermination du nombre de neutron(s) dans un noyau d'atome :
|
Prenons par exemple un atome de Bismuth (Bi). Le numéro atomique du Bi est 83, ce qui signifie qu'un atome de bismuth possède 83 électrons et 83 protons. Regardons aussi sa masse atomique relative (209,0). Ce nombre arrondi détermine aussi combien d'éléments composent le noyaux de l'atome de bismuth (ou nucléons) Voici la représentation par convention des éléments donnés ci-dessus :
Pour trouver le nombre de neutrons qui composent le noyau de bismuth, il suffit de soustraire le numéro atomique à la masse atomique relative arrondie. Soit dans le cas ci-dessus : 209-83 = 126. 126 est le nombre de neutrons. (n) |
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Copyright (c) 2000 - 2023 | Miseur Ludovic | www.lachimie.net | tous droits réservés | remis à jour le : 06/07/2023 |
|
|
|
Comment citer cette page : |
| Miseur, L. (2023). Lachimie.net - Les neutrons. La Chimie.net. http://www.lachimie.net | |
|
|