Configuration électronique des éléments
Nous avons vu que chaque électron d'un atome peut être caractérisé par 4 nombres quantiques : m, l, ml, ms. Regardons, maintenant, grâce à ces coordonnées et à quelques règles simples comment se placent les électrons autour du noyau.
I. Principe d'exclusion de Pauli
m, l, ml, ms , caractérisent un et un seul électron. En effet, deux électrons d'un même élément différent d'au moins un des nombres quantiques. Par conséquent, il peut y avoir au maximum deux électrons par orbitales différant chacun par leur spin (+1/2 pour le premier électron et - 1/2 pour le second).
On peut résumer le principe d'exclusion de Pauli comme ceci : Dans chaque couche, l'on peut mettre au maximum 2n² électrons. (où n est le numéro de la couche).
II. Niveaux d'énergie
Chacune des couches et sous-couches représentent en fait un niveau d'énergie. Ces niveaux d'énergie augmentent en partant du centre vers l'extérieur de l'atome.
Voici le graphique représentant les différentes couches et sous-couches et le niveau d'énergie qui leur est associé :
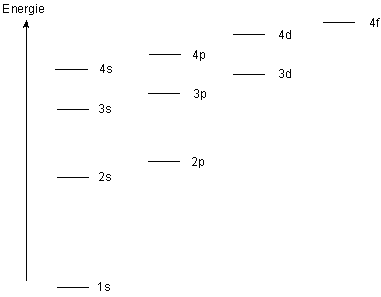
Nous pouvons remarquer que le niveau d'énergie 3d est très très proche du niveau 4s.
III. Principe de construction des atomes
Les électrons se disposent autour du noyau de manière à ce que leur niveau d'énergie soit le plus bas. Pour les niveaux les plus inférieurs, ils se remplissent selon l'ordre intuitif (1s, 2s, 2d ,...). Mais à partir du niveau 3p, l'écart d'énergie entre les orbitales diminue et l'ordre de remplissage diffère de l'ordre intuitif.
La règle de Klechkowsky permet de retenir l'ordre dans lequel se placent les électrons autour d'un noyau :
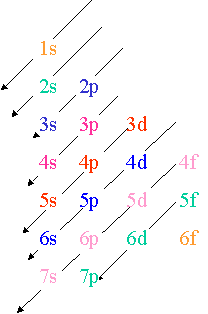 |
Les électrons remplissent progressivement les orbitales dans l'ordre indiqué par les flèches (diagonales)
|
IV. Règle de Hund
Dans des orbitales de même énergie (dans une même couche), les électrons se placent de préférence avec leurs spins parallèles (même chiffre) dans des orbitales différentes. Ceci s'expliquant par un gain d'énergie.
V. Notation et symboles
Nous avons maintenant réuni toutes les règles pour pouvoir détailler la structure électronique de n'importe quel atome. Voyons maintenant comment l'écrire.
ex : Carbone C - 6 électrons
sa structure électronique est : 1s² 2s² 2p² où les chiffres en bleu représentent la couche, la lettre la sous-couche et l'exposant le nombre d'électrons contenus dans la sous-couche. La somme des exposants donnant donc le nombre total d'électrons.
![]() Attention !
Pour pouvoir entamer le remplissage d'une nouvelle couche, il faut que toutes
celles de niveaux d'énergie inférieurs soient remplies !
Attention !
Pour pouvoir entamer le remplissage d'une nouvelle couche, il faut que toutes
celles de niveaux d'énergie inférieurs soient remplies !
-
Notation abrégée :
ex : Calcium - Ca - 20e-
sa structure électronique peut se noter : [Ar] 4s²
Ce qui signifie que l'atome de calcium possède la même configuration que le gaz rare Argon + 4s². Cette notation abrégée fonctionne comme ceci : on donne entre crochet le symbole du gaz rare (He, Ar, Kr, Xe, Rn) et l'on indique ensuite ce qu'il y a en plus de cette configuration du gaz rare.
![]() Attention
! Pour les éléments de numéro atomique 1 à 10, la notation abrégée n'existe
pas !
Attention
! Pour les éléments de numéro atomique 1 à 10, la notation abrégée n'existe
pas !
Exemples :
-
Cu (29e-) : structure complète : 1s² 2s² 2p6 3s² 3p6 3d10 4s² | notation abrégée : [Ar] 3d10 4s1
-
He (2e-) : 1s²
-
O (8e-) : 1s² 2s² 2p4
-
Cl (17e-) : 1s² 2s² 2p6 3s² 3p5 | [Ne] 3s² 3p5
-
On représente également les orbitales et les couches par des "cases atomiques". Chaque case représentant une orbitale (donc 2e- de spin antiparallèle) et l'ensemble de cases accolées symbolisera la couche.
case de la couche 1s avec ces deux électrons représentés chacun par une flèche dont le sens symbolise le spin de l'électron. Les orbitales s peuvent accueillir au maximum 2 électrons.
cases de sous couche p. Les orbitales p peuvent accueillir au maximum 6 électrons.
cases de sous couches d. Les orbitales d peuvent accueillir au maximum 10 électrons.
Pour chaque sous couche, le nombre de cases augmente de 2. et chaque couche peut contenir au maximum 2n² électrons.
Compte tenu de toutes les règles énoncées ci-dessus, voici la configuration électronique de l'atome de Soufre (S) composé de 16e- : 1s² 2s² 2p6 3s² 3p4

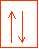
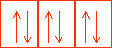
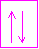
Et celle du Silicium (Si) 14e- : 1s² 2s² 2p6 3s² 3p2

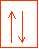
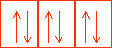
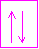
|
|
 |
|
|
Copyright (c) 2000 - 2023 | Miseur Ludovic | www.lachimie.net | tous droits réservés | remis à jour le : 06/07/2023 |
|
|
|
Comment citer cette page : |
| Miseur, L. (2023). Lachimie.net - Configuration électronique. La Chimie.net. http://www.lachimie.net | |
|
|