Les solutions ioniques
I. Introduction
I.1. Qu'est ce qu'une solution ?
Une solution est un mélange homogène (dont on ne peut distinguer les
composants) d'un solvant (la quantité majoritaire) et d'un ou plusieurs solutés.
Par exemple : 5 mL d'éthanol dans 50 mL d'eau; l'eau est le solvant et l'éthanol
le soluté.
Dissolution = Action de dissoudre le soluté dans le solvant.
I.2. Expérience
 |
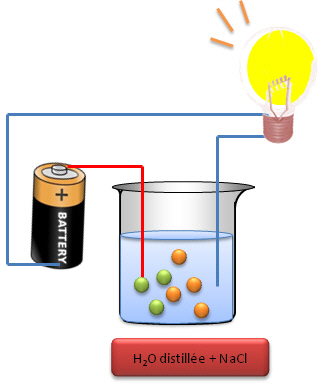 |
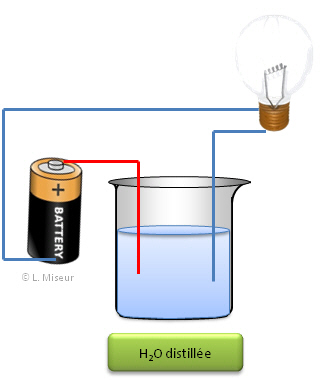
| Avec un récipient rempli uniquement avec de l'eau
distillée (sans ions); la lampe ne s'allume pas alors qu'avec un récipient
dans lequel on a mis une solution de NaCl (sel de cuisine + eau distillée),
l'on observe que l'ampoule s'allume. Une solution ionique est donc
conductrice (permet le passage du courant).
|
|
I.3. Interprétation
Lorsque l'on plonge un cristal de chlorure de sodium (NaCl), qui est un solide composé d'entités chargées : les ions Na+ et Cl-, l'eau va agir afin de rompre les interactions électriques qui lient les différents ions. Les ions vont être ainsi isolés les uns des autres par une "enveloppe" de molécules d'eau. Nous avons alors dans la solution des entités chargées positivement et négativement.
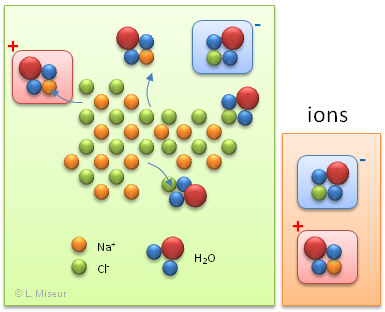
Quand dans le premier cas, nous plongeons deux fils électriques, le courant, qui est un flux de particules négatives (![]() ) n'est pas transporté par l'eau distillée. Il n'y a en effet aucun transporteur de charges capables de transporter les électrons d'une électrode à l'autre. Le circuit est alors ouvert, les électrons sont bloqués.
) n'est pas transporté par l'eau distillée. Il n'y a en effet aucun transporteur de charges capables de transporter les électrons d'une électrode à l'autre. Le circuit est alors ouvert, les électrons sont bloqués.
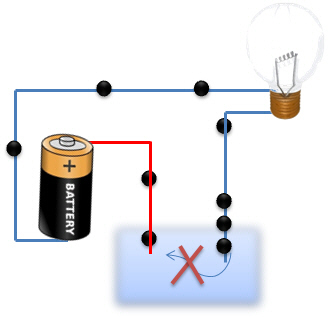
Dans le deuxième cas, les électrodes baignent dans une solution qui contient des ions positifs et négatifs. Ces ions vont servir de "transporteurs" afin d'amener les ![]() d'une électrode à l'autre. Le circuit est alors fermé et l'ampoule s'allume.
d'une électrode à l'autre. Le circuit est alors fermé et l'ampoule s'allume.
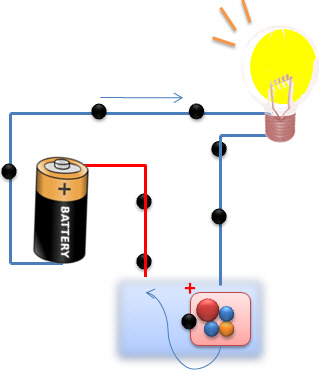
Une des propriétés des solutions ioniques : elles permettent le passage d'électrons. Et comme le courant électrique peut être défini comme le passage d'électrons dans un conducteur, nous pouvons dire qu'une solution ionique permet la conduction d'un courant électrique.
II. Écriture des équations de dissociation
Les composés ioniques réagissent avec l'eau. L'eau sépare les différents ions en les entourant de ses molécules. Les forces électriques liant ces ions sous forme d'un solide n'agissent plus suffisamment et les ions se répartissent dans le solvant (l'eau).
Dans le cas de certains composés présentant des liaisons polarisées, la séparation en ions par réaction avec l'eau est également possible.
Les éléments dans le tableau périodique ne s'ionisent pas tous de la même
façon. Certains perdent des électrons et
d'autres en gagnent, voici les charges que prennent de façon préférentielle les éléments
selon leurs familles.
|
famille |
1 |
2
|
13
|
14
|
15
|
16
|
17
|
18
|
|
ionisation |
X+ |
X2+ |
X3+ |
(*) |
X3- |
X2- |
X- |
- |
(*) Certains éléments de la famille 14 (Sn, Pb) forment des ions positifs.
Les éléments des familles 3 à 12 peuvent former plusieurs types d'ions, celle-ci
dépendra de l'élément avec lequel ils sont associés, il faudra dans ce cas
retrouver la valence de l'élément par la règle du chiasme.
Ionisation pour les groupements d'atomes
|
NH4 |
NH4 + |
|
OH |
OH - |
Tous les autres groupements (à l'exception de NH4) sont des ions négatifs dont la charge peut
être trouvée par l'acide dont ils proviennent ou par la règle du
chiasme !
Comment écrire une réaction de dissociation ?
|
1. |
Vérifier qu'il y a au moins
un composé métallique composant la molécule solide |
MX(s) | exemple : CaCl2(s) |
|
2. |
Écrire la
formule moléculaire du composé dans le membre de gauche. |
MX(s)
|
|
3. |
Dans le
membre de droite décomposer la formule moléculaire en parties M et X |
MX(s)
|
|
4. |
Pondérez l'équation |
MX(s)
|
|
5. |
Dans le
membre de droite ajouter les charges à M et X selon leur place dans
le tableau périodique |
MX
|
|
6. |
Vérifier
que la somme algébrique des charges est bien nulle. |
(2+
+ 2- = 0) |
![]() Les (s)et les (aq) nous informent sur
l'état de la molécule, ainsi (s) signifie à l'état solide et (aq)
à l'état aqueux, en solution. N'oubliez pas d'indiquer ces informations
!
Les (s)et les (aq) nous informent sur
l'état de la molécule, ainsi (s) signifie à l'état solide et (aq)
à l'état aqueux, en solution. N'oubliez pas d'indiquer ces informations
!
III. Soluté ionophore ou ionogène ? :
Définition : un soluté est ionophore
si les ions libérés lors de la dissolution de celui-ci dans un solvant préexistaient dans ce composé.
C'est le cas de composés ioniques tels que NaCl(s), CuCl2(s), NaOH(s), ...
Dans les exemples ci-dessus, les ions formés par la dissolution des composés ioniques cités sont :NaCl (s)
Na+(aq) + Cl-(aq)
CuCl2(s)
Cu2+(aq) + 2 Cl- (aq)
...
Les ions ainsi formés s'entourent ensuite d'un certain nombre de molécules d'eau.
Définition : Un soluté est ionogène
si les ions libérés lors de sa dissolution ne préexistaient pas dans ce composé. La présence d'ions en solution aqueuse résulte alors d'une réaction chimique entre le soluté et les molécules d'eau.
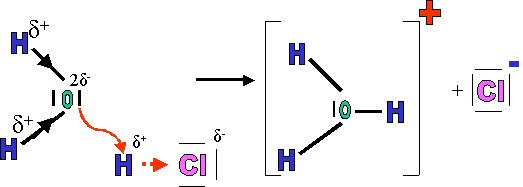
Par exemple, lors de la dissolution d'HCl(g) dans l'eau, L'hydrogène formant la molécule HCl(g) se détache pour aller se fixer sur l'oxygène d'une molécule d'eau.
Au cours de cette réaction, se sont formés des ions qui ne préexistaient pas dans les molécules composant le soluté. Cette réaction se nomme : réaction d'ionisation.
D'autres composés ionogènes forment également des ions par réaction d'ionisation, il s'agit pour la plupart de composés polaires. ( H2SO4, CH3COOH, NH3, ...).

|
Copyright (c) 2000 - 2023 | Miseur Ludovic | www.lachimie.net | tous droits réservés | remis à jour le : 06/07/2023 |
|
|
|
Comment citer cette page : |
| Miseur, L. (2023). Lachimie.net - Solutions ioniques. La Chimie.net. http://www.lachimie.net | |
|
|