Équation de Schrödinger
Nous avons vu qu'à chaque particule l'on peut associer une onde. L'amplitude de l'onde associée à un électron est déterminée par une fonction mathématique : la fonction d'onde ou orbitale :
Cette fonction se note par la lettre grecque psy : ![]()
La fonction d'onde n'a pas de réalité "physique",
elle ne représente rien d'un point de vue physique, par contre ![]() représente la densité électronique en un point (nombre d'e-/nm³)
et permet d'évaluer la probabilité de trouver un électron à cet endroit.
représente la densité électronique en un point (nombre d'e-/nm³)
et permet d'évaluer la probabilité de trouver un électron à cet endroit.
Si l'on calcule sur l'ensemble de l'espace :
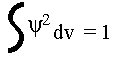
voir le détail de l'équation de Schrödinger
L'atome n'a donc pas de limite physique précise dans l'espace. Pour trouver les fonctions d'ondes, il faut résoudre l'équation de schrödinger.
L'équation et son origine
|
Copyright (c) 2000 - 2023 | Miseur Ludovic | www.lachimie.net | tous droits réservés | remis à jour le : 06/07/2023 |
|
|
|
Comment citer cette page : |
| Miseur, L. (2023). Lachimie.net - Equation de Schroedinger. La Chimie.net. http://www.lachimie.net | |
|
|


