Dilution d'une solution
I. Le principe
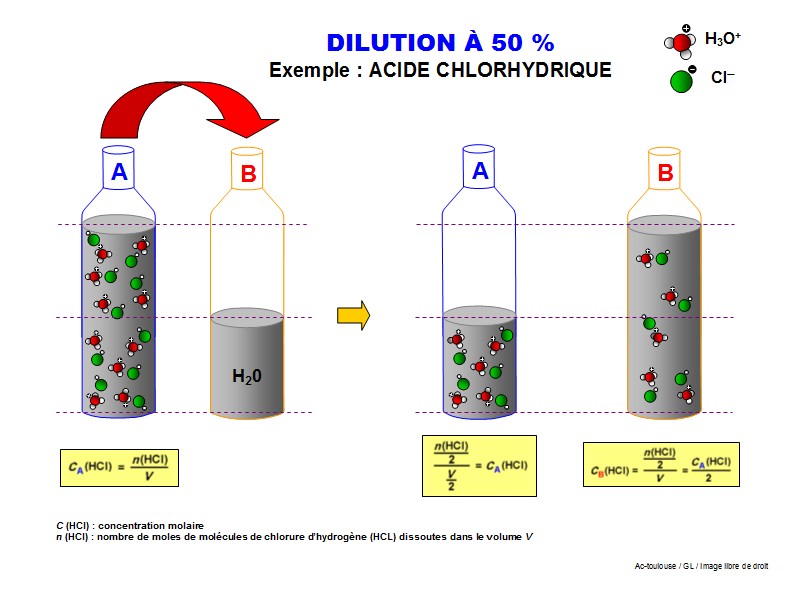
Diluer une solution, c'est diminuer sa concentration. Pour se faire, on rajoute une quantité de solvant (souvent de l'eau distillée) à un volume précis de la solution initiale.
Soit une dilution à 50% : cela signifie que la concentration est divisée par 2. On doit donc diviser par 2 le nombre de molécules présentes par litre de solution. Une façon de procéder serait d'ajouter le même volume de solvant que de solution initiale.
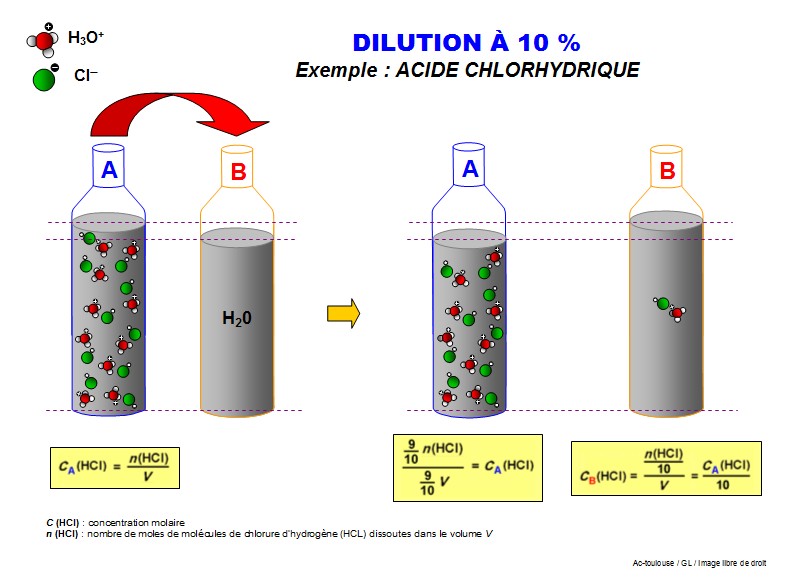
Pour réaliser une solution diluée à 10%, on prendra un volume (1/10) de la solution concentrée et on ajoutera 9 fois ce volume de solvant. (soit 9/10).
II. En pratique
Pour des raisons économiques et écologiques, on essaye de limiter au minimum les pertes de produits. On essaye donc de préparer les quantités de solutions dont nous avons besoin.
Les volumes prélevés doivent être très précis afin de réaliser une bonne dilution, c'est pourquoi du matériel spécifique à ces opérations existe.
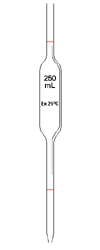
Pipette jaugée (c'est une pipette qui est calibrée afin de prélever un volume très précisément. Elle existe en plusieurs capacités 1mL à 200mL et plus !)
Pipette jaugée
Fiole jaugée - ou [jaugé] (il s'agit d'une fiole calibrée qui permet d'obtenir un volume exacte lors de l'addition de solvant)
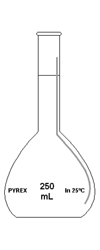
Fiole jaugée
Donc en pratique, si je veux diluer 10 fois une solution, j'utilise par exemple une pipette jaugée de 10 mL et une fiole jaugée de 100 mL (100/10 = 10 fois).
Calcule les dilutions réalisées en utilisant la verrerie indiquée
dilution pipette jaugée fiole jaugée rapport 1 mL 10 mL 10/1 2 mL 10 mL 10/2 10 mL 30 mL 30/10 50 mL 100 mL 100/50
Exemple résolu
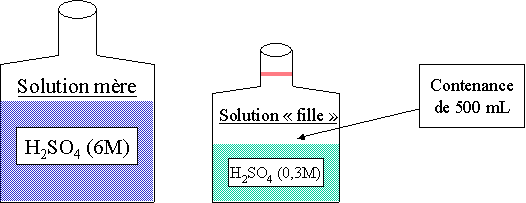
calculer le volume d'une solution aqueuse 6M de H2SO4 , qu'il faut prélever pour obtenir 500 mL de H2SO4 0,3 M.
1. Déterminer le nombre de moles de la solution à préparer : 1000 mL --> 0,3 mole 500 mL --> 0,15 mole 2. Il faut donc prélever 0,15 mole de la solution mère. 3. 1000 mL --> 6 moles 25 mL --> 0,15 mole (0.15 . 1000)/6 4. Répondre à la question : Il faut donc 25 mL de la solution mère à 6M et rajouter de l'eau distillée dans le récipient jusqu'au trait de jauge. Loi des concentrations
De cet exemple, nous pouvons tirer une loi :
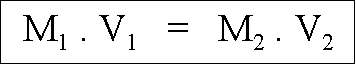
La molarité d'une solution mère (M1) multipliée par son volume (V1) est égale à la molarité d'une solution fille (M2) que multiplie son volume (V2), avec M, la molarité de la solution exprimée en M/L ou Molaire et V, le volume de la solution exprimé en litre(s).
Ce qui donne pour l'exemple ci dessus : 6 . 0,025 = 0,3 . 0,5 on peut donc retrouver le volume qu'il nous fallait en utilisant cette formule : 6 . X = 0,3 . 0,5 --> X = (0,3 . 0,5) / 6 = 0,025 L soit 25 mL.
Ne pas oublier que l'on travaille en litres (L) avec cette loi.
Ci-dessous : une solution de KMnO4 (permanganate de potassium) de concentration 1g/10mL diluée 10 fois entre chaque tube. Nous remarquons que la couleur des solutions diluées diminue avec la dilution. Ceci montre bien que les solutions diluées contiennent moins de molécules que les solutions concentrées.
Solution de KMnO4 (1g / 10 mL) - diluée 10x, 100x et 1000x.
Une solution diluée 1/1000 de KMnO4 peut être utilisée afin de traiter des affections cutanées de type mycoses.
(c) photo : E. Mayné 2010
Simulateur : Concentration et molarité

|
Copyright (c) 2000 - 2023 | Miseur Ludovic | www.lachimie.net | tous droits réservés | remis à jour le : 06/07/2023 |
|
|
|
Comment citer cette page : |
| Miseur, L. (2023). Lachimie.net - Dilution d'une solution. La Chimie.net. http://www.lachimie.net | |
|
|