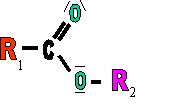Les
esters
I. formation
Un ester résulte de la réaction d'un acide carboxylique et d'un alcool.
L’acide carboxylique perd lors de cette réaction sont groupement |OH| et
l'alcool va perdre un hydrogène |H|, la combinaison de ces éléments
"perdus" formera de l'eau. Donc, un acide et un alcool réagissent
ensemble pour former un ester et de l'eau.
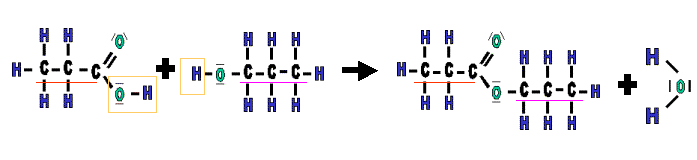
La chaîne carbonée de l'alcool débarrassée de son atome d'hydrogène,
vient prendre la place du groupement OH sur la molécule d'acide.
II. formule générale
|
|
R1 désignant une première chaîne carbonée issue d'un acide carboxylique et R2 étant la chaîne carbonée de l'alcool qui s'est "ajoutée" à l'acide en formant cet ester et de l'eau. |
III. Nomenclature
La nomenclature des esters est composée de deux termes, le premier
terminant en -oate désignant la chaîne carbonée issue de l'acide et le deuxième
terminant par -yle désignant la chaîne carbonée de l'alcool.
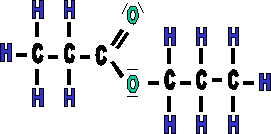 |
1. Déterminer la longueur de la chaîne provenant de l'acide, ici 3 donc propan- et rajouté le suffixe OATE : ---> propanoate |
| 2. Ajouter un "de" après le nom en -oate | |
| 3. Déterminer la longueur de chaîne provenant de l'alcool, ici 3, donc prop, puis terminer par le suffixe -YLE (avec le "e" car en fin de nom.) | |
| 4. Ce qui donne propanoate de propyle |
![]() Pour les composés avec ramifications : exemple :
Pour les composés avec ramifications : exemple :
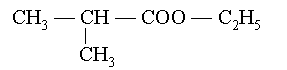 |
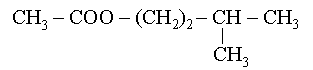 |
||
|
2-méthylpropanoate d’éthyle |
|
IV. Propriétés
IV.1. Odeurs
Beaucoup d'esters ont des odeurs caractéristiques et sont la base de parfums artificiels :| Nom du composé | odeurs |
| Éthanoate d'éthyle | Dissolvant |
| Éthanoate d'hexyle | poires |
| Butanoate d'éthyle | ananas |
| Éthanoate d'octyle | oranges |
| Butanoate de méthyle | pommes |
| Butanoate de pentyle | abricots |
| ... |
... |
IV.2. réaction d'hydrolyse
Un ester de formule générale R-COOR' + H2O donnera deux composés : R-COOH et R'-OH . On peut donc créer un ester à partir d'un alcool et d'un acide, mais l'on peut également récupérer un alcool et un acide d'un ester + H2O.
IV.3. réaction de saponification
Il s'agit de la réaction d'un ester avec une solution de soude (NaOH)
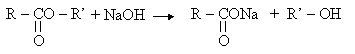
Cette réaction appliquée aux esters particuliers, appelés corps gras permet de fabriquer les savons.
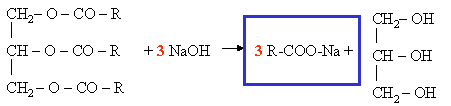
Formule générale d'un savon : R-COONa.
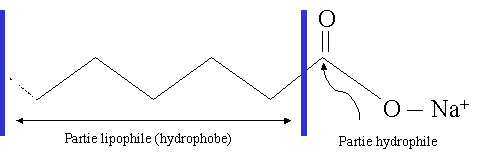
Les savons :
Un savon est constitué de deux parties : une partie polaire hydrophyle (la tête) et une partie non-polaire hydrophobe mais lipophile (qui aime les lipides), ( la chaîne carbonée).
Les molécules de savons s'ionisent au contact de l'eau (H2O). Elles se fixent alors sur les graisses ou les huiles.
La partie lipophile va s'orienter vers les molécules d'huile ou de graisse, tandis que la partie hydrophile s'orientera vers les molécules d'eau.
(C) http://www.ac-montpellier.fr/scphysiques/ | Avec leur aimable autorisation.
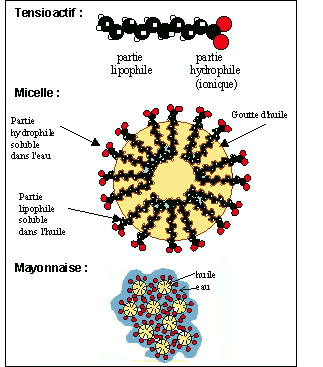
Les têtes polaires vont se repousser, car étant chargées de plus en plus et il va alors se former une micelle, celle-ci polaire extérieurement va rester dans l'eau. Les micelles étant toutes chargées de même signe se repousseront l'une l'autre évitant la reformation d'un amas de graisses/huiles.
|
Copyright (c) 2000 - 2023 | Miseur Ludovic | www.lachimie.net | tous droits réservés | remis à jour le : 06/07/2023 |
|
|
|
Comment citer cette page : |
| Miseur, L. (2023). Lachimie.net - cours de chimie et ressources didactiques pour apprendre les savoirs disciplinaires, les savoir-faire et compétences de base des sciences chimiques. La Chimie.net. http://www.lachimie.net | |
|
|