Les molécules
I. Modélisation des molécules
La matière est faite de molécules, composées d'atomes, mais comment représenter ces molécules ?

De nombreuses façons de représenter les molécules existent. L'une d'elle est de représenter simplement les molécules par des boules colorées et une variante est de représenter les atomes qui constituent la molécule en réalisant un assemblage de boules colorées, chaque boule représentant alors un atome.
 |
 |
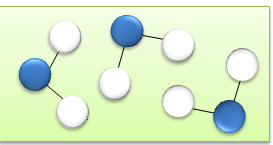 |
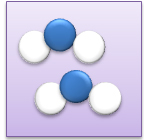
| Représentation des molécules d'eau sous forme de boules bleues | Représentation des molécules d'eau mettant en évidence sa composition atomique (2 hydrogènes (blanc) et 1 oxygène (bleu)) | Représentation des molécules d'eau mettant en évidence sa composition atomique (2 hydrogènes (blanc) et 1 oxygène (bleu)) et la forme moyenne de la molécule |
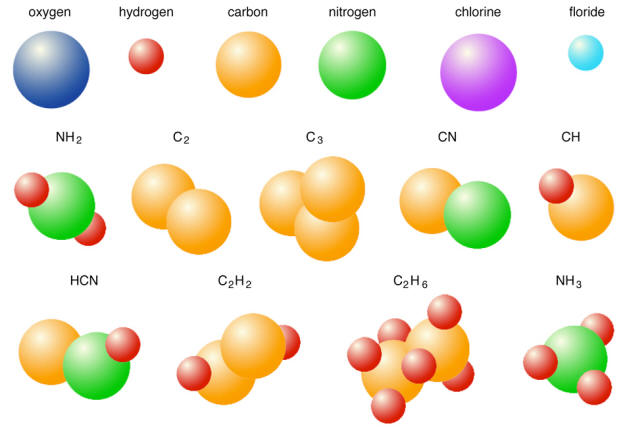
Représentation de molécules mettant en évidence la composition atomique et légende
Ces représentations permettent de mettre en évidence certaines caractéristiques des molécules mais n'est vraiment pas commode. La première représentation sous forme de boules est la moins précise, elle ne permet pas de mettre en évidence la composition de la molécule, ni sa géométrie. De plus les molécules ne ressemblent pas à des petites boules !
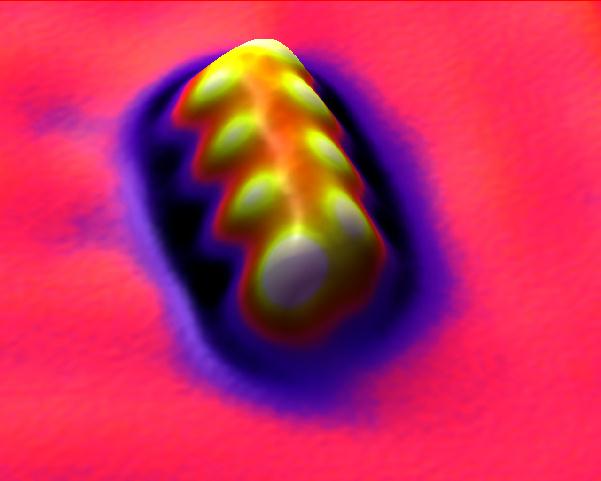
Observons l'image d'une molécule réalisée par IBM avec un microscope à effet tunnel :
|
Molécule correspondant à l'assemblement de 8 atomes de césium et 8 atomes d'iode (c) Hopkinson, Lutz & Eigler -Cesium & Iodine on Copper (111) | http://www.almaden.ibm.com/vis/stm/hexagone.html |
Nous voyons bien que cette molécule n'est pas une sphère ! Elle semble plutôt linéaire.
Notre façon de représenter les molécules sous formes de boules colorées ou même d'un assemblage de boules colorées n'est donc pas la plus adéquate. Elle devient surtout fastidieuse lorsque nous devons écrire les molécules dans un texte ou résoudre des équations chimiques.
... Sans oublier les problèmes liés à l'utilisation des couleurs (daltoniens...), la définition d'une légende universelle, ...
II. Formules moléculaires
Pour représenter facilement les molécules, les chimistes ont préférés laisser de côté les problèmes de formes et de géométries et ont décidés d'utiliser une écriture SYMBOLIQUE.
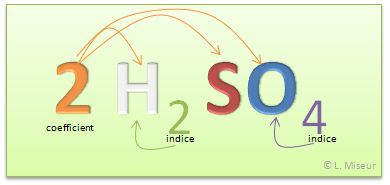
Pour symboliser une molécule, on utilise les symboles des atomes, ceux-ci ordonnés selon des conventions et mettant en évidence la composition des molécules grâce à des coefficients et des indices.
|
|
|
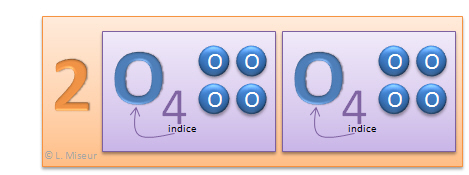
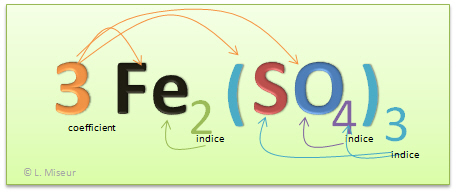
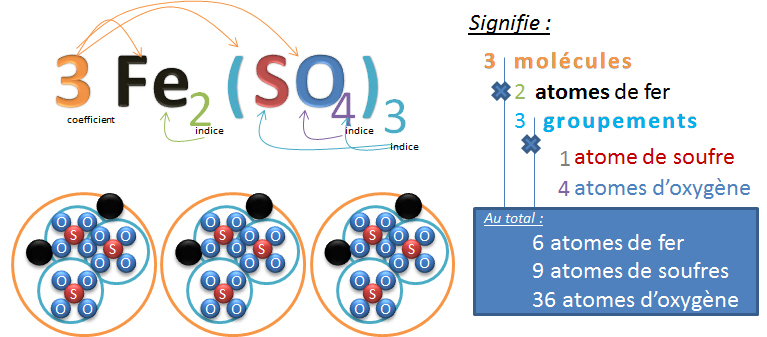
pour représenter une molécule, nous utilisons une formule chimique (ex: H2SO4 : une molécule de sulfate d'hydrogène) en orange, devant la molécule , c'est le coefficient , il se distribue sur tous les atomes qui forment la molécule en blanc, rouge et bleu, c'est les atomes (symboles) Hydrogène, Soufre et Oxygène en vert et mauve, c'est l'indice , celui-ci multiplie l'atome qu'il précède (Il y a donc 4 atomes d'oxygène par molécule) |
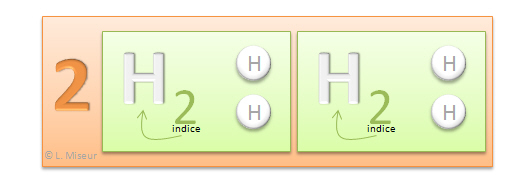
Nombre d'atomes : 2.2 H = 4 atomes d'H (hydrogène)
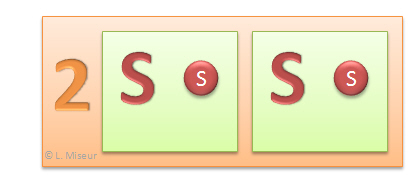
2.1 S = 2 atomes de S (soufre)
2.4 O = 8 atomes d'O (oxygène)
Nombre de molécules : 2 (c'est le coefficient devant la molécule)
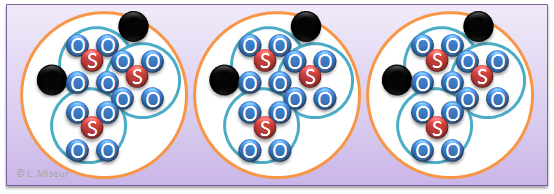
Dans l'exemple donné, il n'y a pas que deux éléments différents qui composent cette molécule, il y en a trois. SO4 est en fait un groupement, c'est à dire une mini molécule qui se comporte comme si il ne s'agissait que d'un atome lorsque l'on construit la molécule sur papier. Ce groupement peut aussi être soumis à l'effet d'un indice, dans ce cas, le groupement est mis entre parenthèses et l'indice se note en dessous de la parenthèse. Exemple : Fe2(SO4)3
Quelques illustrations
(extraites du site de J. Thonnard - www.proftnj.com)
| écriture chimique (SYMBOLISME) | représentation (selon le modèle des boules) | signification |
| Cl |
|
1 atome non lié |
| 2 Cl |
|
2 atomes non liés |
| Cl2 |
|
1 molécule (avec 2 atomes liés) |
| 2 Cl2 |
|
2 molécules (avec 2 atomes liés par molécule) |
| 4 Cl |
|
4 atomes non liés |
| 4 Cl2 |
|
4 molécules (avec 2 atomes liés par molécule) |
| écriture chimique | nombre total d'atomes différents |
| 2 O3 | 6 O |
| Fe2O3 | 2 Fe, 3 O |
| Mg(OH)2 | 1 Mg, 2 O, 2 H |
| Cu(NO3)2 | 1 Cu, 2 N, 6 O |
| 2 K3Co(NO2)6 | 6 K, 2 Co, 12 N, 24 O |
| 2 molécules contenant chacune 3 atomes d'oxygène | 2 O3 |
| 1 molécule contenant 1 atome de magnésium et 2 groupements contenant chacun 1 atome d'oxygène et 1 atome d'hydrogène | Mg(OH)2 |
| 3 molécules contenant chacune 2 atomes d'aluminium et 3 groupements contenant chacun 1 atome de soufre et 4 atomes d'oxygène | 3 Al2(SO4)3 |
Construire des molécules
 | |
Réservé à une utilisation strictement privée-tous droits de reproduction et de diffusion réservés - (c) L. Miseur - La chimie.net 2010 | |
|
Copyright (c) 2000 - 2023 | Miseur Ludovic | www.lachimie.net | tous droits réservés | remis à jour le : 06/07/2023 |
|
|
|
Comment citer cette page : |
| Miseur, L. (2023). Lachimie.net - Molécules. La Chimie.net. http://www.lachimie.net | |
|
|