Les fonctions chimiques
I. Formules et fonction
I.1. La formule générale
Règles et conventions pour déterminer la formule générale d'un composé chimique au départ de sa formule moléculaire.
Conventions
- on remplace les symboles des éléments métalliques (ou à prédominance métallique) par le symbole général M;
- on remplace les symboles des éléments non-métalliques (ou à prédominance non-métallique) par le symbole général X;
- on conserve les symboles de l'oxygène O et de l'hydrogène H;
- on supprime les indices et les parenthèses.
De la sorte, nous obtenons les formules générales d'un nombre limité de corps purs composés:
| Formule moléculaire | Formule générale | Formule moléculaire | Formule générale |
| HNO3 | HXO | Fe2O3 | MO |
| Al2(SO4)3 | MXO | H2S | HX |
| NaCl | MX | KOH | MOH |
| CO2 | XO | H2SO4 | HXO |
| CuO | MO | N2O3 | XO |
| Mg(OH)2 | MOH | AgNO3 | MXO |
On constate qu'il n'y a que 7 catégories de corps purs composés dont les formules générales sont: HXO, MXO, MX, XO, MO, MOH et HX.
I.2. Les fonctions chimiques
La matière qui nous entoure peut être classée selon plusieurs critères, un premier classement sépare les corps purs des mélanges. Un corps purs est une matière composée de molécules identiques ayant toutes la même propriété que cette matière à l'échelle atomique.
Un second classement peut s'opérer au point de vue de la composition chimique des molécules qui composent se corps purs. Selon le type d'atomes et la réactivité chimique (la façon dont réagissent les corps purs) d'autres grandes classification de la matière peuvent être faites au départ des corps purs.
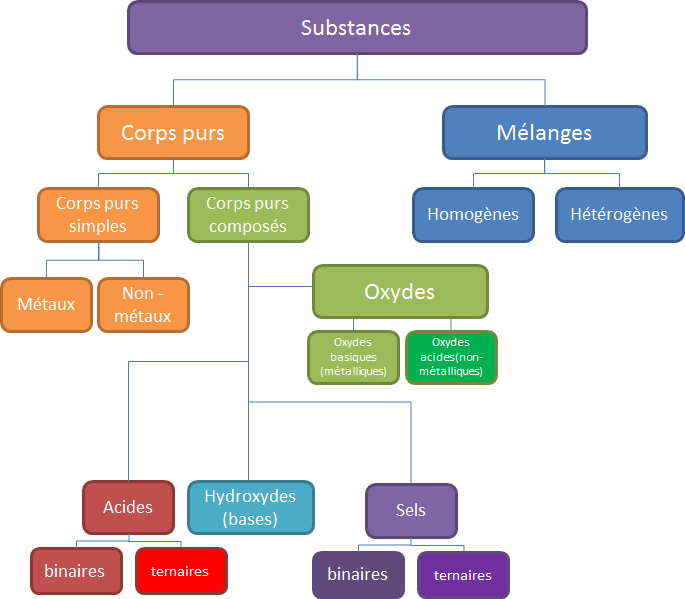
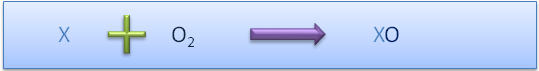
Formule générale Nom de la formule générale (nom de la fonction chimique) Exemple MO Oxyde métallique Fe2O3 XO Oxyde non-métallique CO2 MOH Hydroxyde (base hydroxylée) Ca(OH)2 HX Acide binaire (hydracide) HCl HXO Acide ternaire (oxacide) H3PO4 MX Sel binaire (sel d'hydracide) KCl MXO Sel ternaire (sel d'oxacide) Al2(SO4)3 soit 4 grandes fonctions (catégories):
Oxydes:
MO et XOHydroxydes ou bases hydroxylées:
MOHAcides:
HX et HXOSels:
MX et MXO
II. Caractéristiques des différentes fonctions
II.1. Les Oxydes non-métalliques
Formule générale : XO
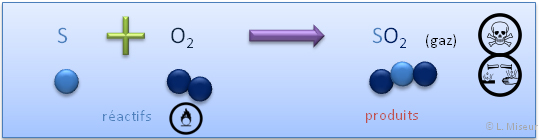
Un oxyde non-métallique est le résultat de la combustion d'un non-métal (corps pur simple). C'est à dire, sa réaction avec du dioxygène (O2).
Exemple : Combustion du soufre dans le dioxygène
Réaction :
Obtention : réaction d'un non-métal avec le dioxygène
Quelques oxydes non-métalliques et leurs utilisations :
- N2O : protoxyde d'azote : "gaz hilarant", utilisé comme anesthésiant
- CO2 : dioxyde de carbone : à -78°C, il se présente sous forme d'un solide blanc, c'est la glace carbonique.
- CO : monoxyde de carbone : gaz inodore et incolore qui est produit lors de mauvaise combustion. Il est extrêmement toxique et cause chaque année des centaines de décès.
II.2. Oxyde métallique
Formule générale : MO
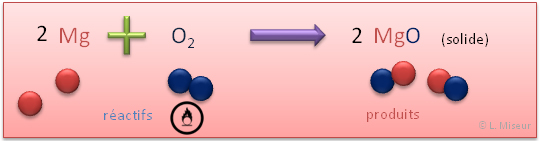
Un oxyde métallique est le produit de la réaction de combustion d'un métal avec le dioxygène.
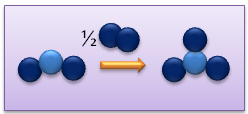
Exemple : Combustion du magnésium dans le dioxygène
Réaction :
Obtention : réaction d'un métal avec le dioxygène
Quelques oxydes métalliques et leurs utilisations :
- MgO : Oxyde de magnésium : utilisé sous forme de briques dans les fours industriels. L'oxyde de magnésium est un matériau réfractaire.
- PbO : Oxyde de plomb (II) : utilisé comme électrode dans les accumulateurs au plomb.
- Al2O3 : Oxyde d'aluminium : minerai (source naturelle) d'aluminium. Ce minerai est appelé Bauxite
- Cr2O3 : Oxyde de Chrome (III) : source naturelle (minerai) de chrome.
- Fe2O3 : Oxyde de Fer (III) : source naturelle (minerai) de fer. Ce minerai est appelé Hématite.
II.3. Hydroxyde (base hydroxylée)
Formule générale : MOH
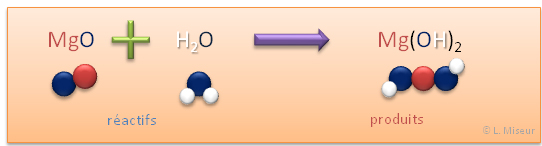
Exemple : réaction de l'oxyde de magnésium avec l'eau
Obtention : réaction d'un oxyde métallique avec l'eau.
Le composé formé est un hydroxyde ou base hydroxylé. Il a est basique. Les hydroxydes sont des bases.
Les bases peuvent être caractérisées selon les critères suivants :
Les bases sont caustiques, ont une saveur amère et bleuissent le tournesol.
Les bases peuvent être détectées en utilisant des indicateurs.
Un indicateur est une substance qui change de couleur selon le milieu dans lequel elle se trouve. Ainsi, les indicateurs permettent selon leur couleur de détecter si une substance est plutôt basique ou plutôt acide.
Voici quelques indicateurs et les couleurs qu'ils prennent en présence d'acide ou de base :
Quelques autres indicateurs acide-base
Quelques hydroxydes et leurs utilisations :
- Mg(OH)2 : Hydroxyde de magnésium aussi appelé lait de magnésium est utilisé comme antiacide pour l'estomac
- NaOH : Hydroxyde de sodium appelé couramment soude caustique est utilisé comme déboucheur (Destop®)
- KOH : Hydroxyde de potassium appelé aussi soude potassique est utilisé en biologie.
- Al(OH)3 : Hydroxyde d'aluminium : anti-transpirant, déodorant.
> Attention ! Les hydroxydes sont caustiques et brûlent la peau en s'attaquant à une des protéines (molécule particulière) qui la compose.
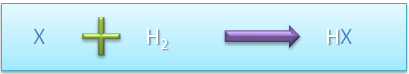
II.4. Acide binaire (hydracide)
Formule générale : HX
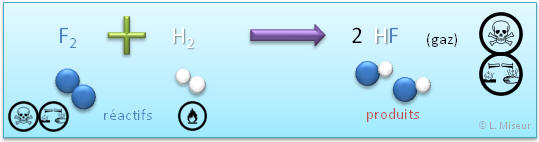
Exemple : réaction du difluor avec le dihydrogène
Cette réaction permet de produire du fluorure d'hydrogène (acide fluorhydrique) utilisé afin de graver le verre. (Cette substance est l'une des rares qui attaque le verre. Elle est utilisée dans la gravure sur verre)
Protocole de gravure sur verre (Par Saint-Just) - http://www.saint-gobain-glass.com/saint-just/
DESCRIPTION
La gravure à l’acide est une des méthodes de gravure (il existe également le sablage). C’est un enlèvement de matière par voie chimique. Elle fait apparaître le verre sous
des aspects différents (transparent, dépoli ou dégradé).
A/ PRÉPARATION
1) Nettoyer le verre support face émail avec de l’éthanol
(cf Photo n°1).
2) Poser votre pochoir sur la couche d’émail (cf Photo n°2).
3) Laisser uniquement la zone à graver apparente. Pour
cela, utiliser du vinyle ou du scotch : faire un réservoir ou butyl pour éviter la dispersion de l’acide (cf photo 3)
B/ GRAVURE
4) Remplir le bécher en téflon d’acide fluorhydrique à
40%. En verser de petites quantités sur la surface à
graver. (cf Photo n°4).
5) Étaler l’acide fluorhydrique à l’aide d’un pinceau jusqu’à l’obtention du rendu souhaité. Rajouter de l’acide fluorhydrique si nécessaire (cf Photo n°5)
C/ RINÇAGE
6) Rincer à l’eau abondamment (cf Photo n°6)
7) Retirer le scotch et le pochoir (cf Photo n°7).
A noter : le temps de gravure peut varier fortement en fonction de la taille du motif à graver et du type de lettrage (détails), de la quantité de matière active, de l’épaisseur de la couche d’émail et la teinte de base. Il conviendra donc d’intégrer ces points dans le temps de préparation des projets. Le rendu varie selon la dilution en % de la dilution aqueuse de l’acide, le temps d’exposition et l’épaisseur de la couche d’émail. Pour les verres opales et sélénium, renouveler régulièrement l’acide (car saturation rapide).Télécharger la fiche technique explicative
Obtention : réaction d'un élément non-métallique avec le dihydrogène
Le composé formé est un acide binaire. C'est un acide.
Les acides peuvent être caractérisés selon les critères suivants :
Les acides ont une saveur aigre, rougissent le papier indicateur (tournesol) et réagissent avec les bases pour former des sels. Quelques acides binaires et leurs utilisations :
- HF : Fluorure d'hydrogène : gravure sur verre
- HCl : Chlorure d'hydrogène : utilisé dans la production des matières plastiques, utilisé également comme détartrant et comme décapant.
- HBr : Bromure d'hydrogène : utilisé en chimie organique (synthèse et catalyseur).
II.5. Acide ternaire (oxacide)
Formule générale : HXO
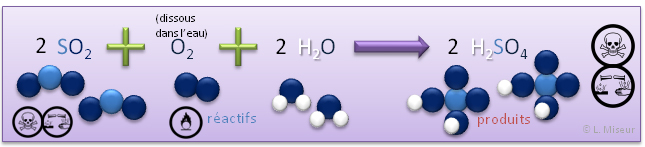
Exemple 1: réaction du dioxyde de soufre avec l'eau (en présence d'oxygène)
L'acide sulfurique peut être produit au départ de dioxyde de soufre, toutefois, le dioxyde de soufre devra d'abord réagir avec le dioxygène pour former du trioxyde de soufre, qui lui réagit avec l'eau pour former l'acide sulfurique (sulfate d'hydrogène).
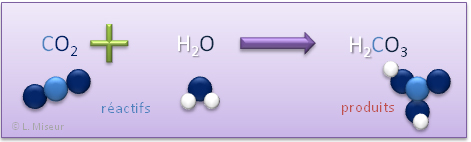
Exemple 2 : réaction du dioxyde de carbone avec l'eau
C'est ce phénomène qui est à l'origine des grottes. En effet, l'eau de pluie se charge en dioxyde de carbone et devient acide. Cette acidité attaque le calcaire et creuse des grottes.
Obtention : réaction d'un oxyde non-métallique avec l'eau
Quelques acides ternaires et leurs utilisations :
- H2SO4 : Sulfate d'hydrogène (acide sulfurique) : utilisé dans les accumulateurs et composant des pluies acides.
- H3PO4 : Phosphate d'hydrogène (acide phosphorique) : acidifiant, présent notamment dans le Coca-Cola.
- HNO3 : Nitrate d'hydrogène (acide nitrique) : intervient dans la fabrication des engrais azotés. Mélangé au chlorure d'hydrogène il forme l'eau régale, un acide puissant capable de dissoudre l'or.
II.6. Sel binaire (sel d'hydracide)
Formule générale : MX
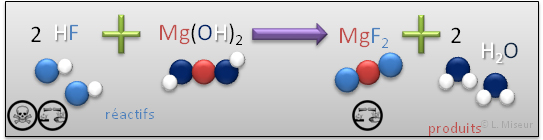
Exemple: réaction du fluorure d'hydrogène avec l'hydroxyde de magnésium
Obtention : réaction d'un acide binaire avec un hydroxyde
Quelques sels binaires et leurs utilisations :
- NaCl : Chlorure de sodium : sel de cuisine.
- CaCl2 : Chlorure de calcium : sel de déneigement.
- CaF2 : Fluorure de calcium : cristal de fluorine utilisé en bijouterie :
- MgCl2 : Chlorure de Magnésium : permet de coaguler le lait de soja pour la fabrication du tofu.µ
SiCl4 : Chlorure de silicium : nuage artificiel.
CrCl3: Chlorure de chrome (III) : traitement imperméabilisant des textiles.
II.7. Sel ternaire (sel d'oxacide)
Formule générale : MXO
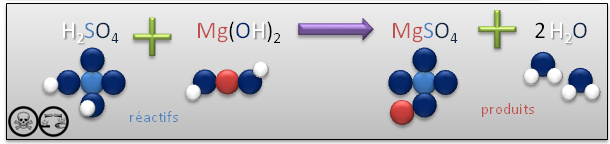
Exemple: réaction du sulfate d'hydrogène avec l'hydroxyde de magnésium
Obtention : réaction d'un acide ternaire avec un hydroxyde
Quelques sels ternaires et leurs utilisations :
- MgSO4 : Sulfate de magnésium (Sels d'Epson) : utilisé comme laxatif.
- Na2CO3 : Bicarbonate de soude : utilisé comme antiacide pour l'estomac ou anti-odeur.
- PbCrO4 : Chromate de plomb : pigment jaune (marquage de travaux sur autoroute). (toxique)
- PbSO4 : Sulfate de plomb : pigment jaune (toxique).
- BiVO4 : Vanadate de bismuth : pigment jaune (substitut non toxique)
III. Tableau de synthèse des différentes fonctions
Complète le tableau ...
Formule générale Nom de la formule générale (nom de la fonction chimique) Formation / type de réactivité Exemple X + O -> XO P2O5 M + O -> MO Na2O MO + H2O ->MOH LiOH X + H2 -> XH H Br XO + H2O -> HXO HNO3
MOH + HX -> MX + H2O PbCl2 MOH + HXO -> MXO + H2O
Ba3( PO4 )2
IV.Exercices



Réservé à une utilisation strictement privée-tous droits de reproduction et de diffusion réservés - (c) L. Miseur - La chimie.net 2010
Copyright (c) 2000 - 2023 | Miseur Ludovic | www.lachimie.net | tous droits réservés | remis à jour le : 06/07/2023
Comment citer cette page : Miseur, L. (2023). Lachimie.net - Les fonctions chimiques. La Chimie.net. http://www.lachimie.net