Nombres quantiques et orbitales
De l'équation de Schrödinger l'on peut tirer les orbitales atomiques, qui sont des portions de l'espace (volume) dans lesquels il y a une grande probabilité de trouver l'électron.
I. Les trois premiers nombres quantiques :
Chaque orbitale atomique est caractérisée par 3 nombres quantiques, le quatrième ne concerne que l'électron.
| n | le nombre quantique principal | désigne la couche | prend des valeurs d'entiers non-nuls : 1, 2, 3, 4,... |
|
|||
| l | nombre quantique secondaire ou azimutal | désigne la sous-couche | prend des valeurs entières de 0 à (n-1). si n = 2 ; l = 0 ou 1 |
|
|||
forme des orbitales
- orbitales s : sphérique
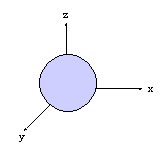
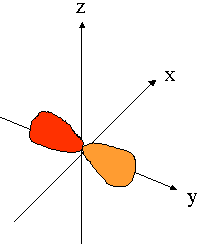
- orbitales p : plan nodal
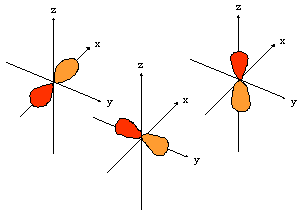
- orbitales d : 4 lobes avec 2 surfaces nodales
Il existe encore des orbitales f et g
| ml | nombre quantique magnétique orbitalaire | caractérise l'orientation dans l'espace. | prend des valeurs entières. |
|
|||
Ainsi chaque orbitale existe en versions différentes (orientations dans l'espace différentes) :
- orbitales s : sphérique
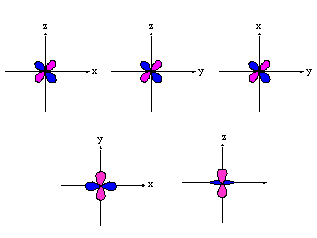
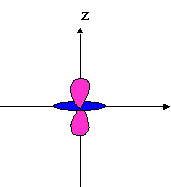
- orbitales p : plan nodal
| orienté selon l'axe "px" | orienté selon l'axe "py" | orienté selon l'axe "pz" |
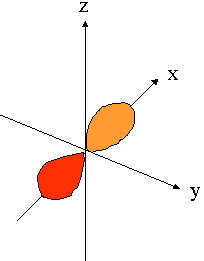 |
 |
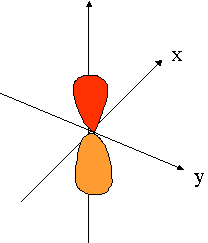 |
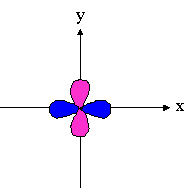
- orbitales d : 4 lobes avec 2 surfaces nodales
| dxz | dyz | dxy |
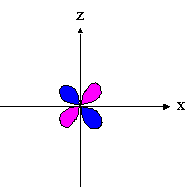 |
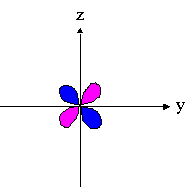 |
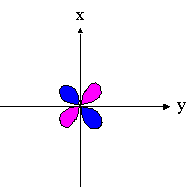 |
|
dx²-y² |
dz² |
|
 |
 |
II. Le spin de l'électron
Le 4ième nombre quantique
L'électron est animé d'un mouvement propre. Il tourne sur lui même comme une toupie. Ce mouvement de rotation de l'électron sur lui même engendre un moment magnétique. (une charge en rotation engendre un moment magnétique, or l'électron est une particule chargée) Ce moment magnétique se nomme le SPIN et est quantifié : les valeurs de spin sont +1/2 ou -1/2.
![]()
![]()
Ce moment magnétique constitue le quatrième nombre quantique, le nombre quantique magnétique de spin noté ms.
| ms | nombre quantique magnétique de spin | désigne l'orientation du spin | prend les valeurs +1/2 ou -1/2 uniquement |
|
|||
 En résumé
En résumé
chaque électron d'un atome peut être caractérisé par 4 nombres quantiques : n, l, ml, ms. La combinaison de ces quatre nombres est unique pour un électron donné. Par conséquent, deux électrons d'un même atome différeront toujours d'au moins un nombre quantique. (principe de Pauli)
|
Copyright (c) 2000 - 2023 | Miseur Ludovic | www.lachimie.net | tous droits réservés | remis à jour le : 06/07/2023 |
|
|
|
Comment citer cette page : |
| Miseur, L. (2023). Lachimie.net - Nombres quantiques et orbitales. La Chimie.net. http://www.lachimie.net | |
|
|