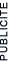Les isotopes
I. Les isotopes
Etymologie
ISOS : (grec) même, identique / TOPOS : lieu
Définition :
Isotope signifie par étymologie : même lieu. Ce sont en effet des éléments chimiques qui se retrouvent dans la même case que d'autres dans le tableau périodique, car ils possèdent les mêmes propriétés chimiques que l'élément qui le représente. La seule différence entre les isotopes d'un même élément se trouve au niveau du nombre de nucléons (particules) composant leur noyau. C'est le nombre de neutrons, particules neutres qui varie selon les isotopes.
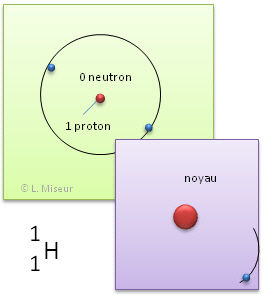
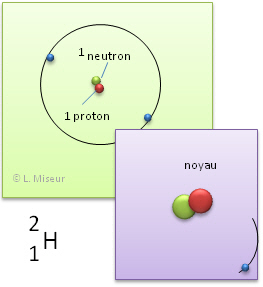
Exemple: l'hydrogène. Il existe d'autres atomes qui ont les mêmes propriétés chimiques que l'élément hydrogène. Ils ont le même nombre de protons et d'électrons, mais leurs nombres de neutrons sont différents.
- C'est le nombre de protons qui détermine l'élément, le nombre de neutrons n'intervient pas. Un atome dont le noyau est composé de 3 protons est un atome de lithium, et reste un atome de lithium avec 1, 2 ou 3 neutrons.
- Pour les différents isotopes d'un élément, le nombre de protons est identique, seul le nombre de neutrons varie.
- Plus un isotope possède des neutrons, plus sa masse augmente (plus il est lourd). En effet la masse du neutron est pratiquement équivalente à la masse d'un proton.
|
|
|
|
1H (élément le plus courant) |
2H (isotope 2 de l'hydrogène) |
|
|
|
3H (isotope 3 de l'hydrogène) |
Ces atomes ont les mêmes propriétés chimiques. En effet, ces propriétés sont déterminées par le nombre d'électrons et celui-ci reste identique. ATTENTION ! Ces atomes n'ont pas les mêmes propriétés physiques (leur masse est déjà différente).
II. Isotopes et masse atomique
III. Les isotopes du carbone
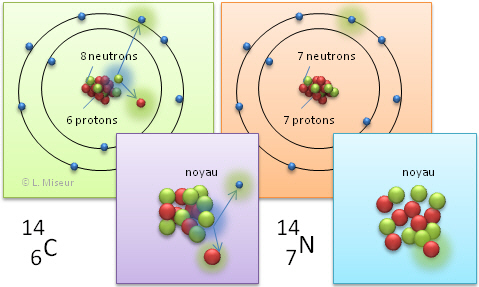
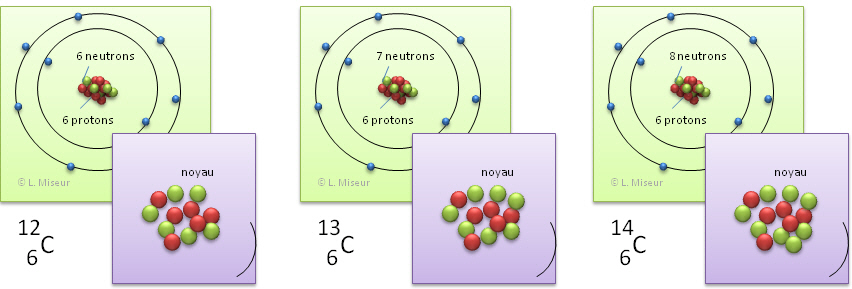
Il existe 3 isotopes pour le carbone : 12C, 13C, 14C, respectivement avec un noyau composé de 6 neutrons, 7 neutrons et 8 neutrons.
Un des isotopes du Carbone est particulièrement célèbre !
Tu as certainement déjà entendu parler du carbone "14". Il s'agit d'un isotope du carbone dont le noyau est composé de 14 nucléons : 6 protons et 8 neutrons.
Cet isotope du carbone n'est pas stable dans le temps. Il est radioactif. C'est à dire qu'il se désintègre petit à petit en émettant des radiations. Mais il a les mêmes propriétés chimiques que le carbone 12 (l'isotope le plus courant du Carbone), même s'il est un peu plus lourd. Donc le carbone 14 peut entrer dans la composition de n'importe quel être vivant.
Les scientifiques ont déterminé un temps de demi-vie (appelé la période radioactive) pour le carbone 14. C'est le temps que met une masse de carbone 14 pour être désintégrée en azote et réduite de moitié.
Le temps de demi vie du 14C est de 5580 ans avec une marge d'erreur de +/- 30 ans, donc si l'on stocke 60 g de cet isotope radioactif, après 5580 ans, il n'en restera plus que 30g, le reste s'étant désintégré en atomes d'azote et en électrons.
Le carbone et ses différents isotopes est naturellement présent dans l'atmosphère et est capté par les organismes qui le stocke durant toute leur vie. Une fois l'organisme mort, les quantités de carbone accumulées ne sont plus renouvelées et l'isotope 14 du carbone se désintègre sans être remplacé.
En mesurant le rapport 14C/Ctotal d'un échantillon (12C + 13C + 14C), l'on peut déterminer l'âge de celui-ci. Ainsi, un rapport de 1% correspond à environ 80 ans.
Quelques limites à la datation par 14
- On ne peut dater que des objets ou échantillons contenant du carbone.
- Après 8 périodes radioactives (8 temps de demi-vie), le taux de 14C n'est plus que de 0,4% du nombre de 14C de départ, l'on ne peut donc dater des objets que de maximum 46 000 ans.
- La mesure se base sur le rapport 14C/Ctotal des échantillons, Or, on ne peut être sûr que la concentration de 14C ait été stable dans l'atmosphère sur plusieurs siècles. On se base dans la méthode de datation sur un rapport déterminé pour le XVIIIe siècle.
Exemple de datation au 14C
- Datation des objets retrouvés dans les grottes de Lascaux (hommes préhistoriques)
- Datation d'objets provenant de tombeaux égyptiens
- Datation de documents papiers (le papier est réalisé à partir de végétaux)
Cette méthode de datation a été développée en 1948 par Libby Frank Wilard afin de dater des objets en bois issus d'un tombeau égyptien. Ses travaux sur le 14C lui ont valu le prix Nobel en chimie.
info : http://fr.wikipedia.org/wiki/Datation_par_le_carbone_14
IV. Exercices
![]()
|
I. Pour les isotopes suivants : indiquer le nombre de masse (nucléons), le nombre de protons et de neutrons. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
14C (isotope 14 du carbone) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
II.
Sélectionnez toutes les espèces isotopes parmi les suivantes.
III. Calculez les masses atomiques relatives des éléments suivants (2 décimales).
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 | |
Réservé à une utilisation strictement privée-tous droits de reproduction et de diffusion réservés - (c) L. Miseur - La chimie.net 2012 | |
|
Copyright (c) 2000 - 2023 | Miseur Ludovic | www.lachimie.net | tous droits réservés | remis à jour le : 06/07/2023 |
|
|
|
Comment citer cette page : |
| Miseur, L. (2023). Lachimie.net - Les isotopes. La Chimie.net. http://www.lachimie.net | |
|
|