Modèle des solutions aqueuses
I. Expérience : conductivité de solutions
| solution | conductivité (mS) (siemens, S, unité de mesure de la conductivité) |
| H2O distillée | 20 |
| H2O (eau de distribution) | 560 |
| NH3 0,05 M | 325 |
| CH3-COOH 0,05 M | 236 |
| C6H12O6 0,05 M | 43 |
| HCl 0,05 M | 13000 |
| NaCl 0,05 M | 3700 |
Toutes les valeurs dans le tableau ci-dessus ont été déterminées de manière expérimentale.
Observations
H2O distillée n'est pratiquement pas conductrice, car il y a très peu d'ions dans la solution.
NH3, H2O (distribution), CH3-COOH sont faiblement conducteurs, il y a peu d'ions => électrolytes faibles.
C6H12O6 même comportement que l'eau distillée, très peu d'ions : non-électrolyte.
HCl et NaCl sont fortement conducteurs, il y a donc beaucoup d'ions dans la solution, ce sont des électrolytes forts.
Définition d'électrolyte
- substance qui conduit le courant en solution aqueuse.
II. Classement de solutions aqueuses
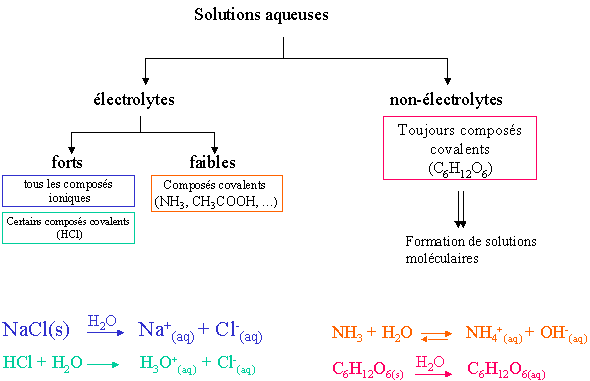
Certains composés covalents ( les acides) sont des électrolytes. Certains réagissent totalement avec l'eau, d'autres forment un système à l'état d'équilibre. Un exemple de dissolution dans l'eau pour chacun des différents types de composé est donné.
|
Copyright (c) 2000 - 2023 | Miseur Ludovic | www.lachimie.net | tous droits réservés | remis à jour le : 06/07/2023 |
|
|
|
Comment citer cette page : |
| Miseur, L. (2023). Lachimie.net - Modèle des solutions aqueuses. La Chimie.net. http://www.lachimie.net | |
|
|


