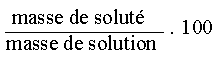Concentration d'une solution
I. La concentration molaire
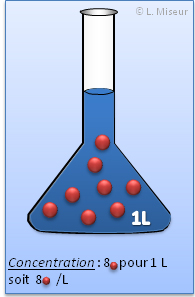
Définition
C'est le nombre de mole présentes par volume de solution.
Cette concentration est la plus couramment utilisée lorsque l'on travaille avec des solutions.
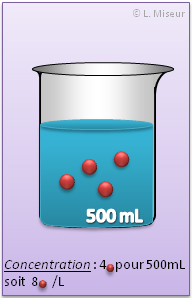
Les concentrations molaire sont exprimées par-rapport à 1 LITRE de solution. C'est donc le nombre de mole présent pour 1 litre de solution.
Formulation mathématique
Unité
mol.L-1 ou mol/L
Une solution de concentration 1 mol.L-1 contient 1 mole de soluté dans 1 litre de solution.
Laboratoire virtuel : réaliser des solutions
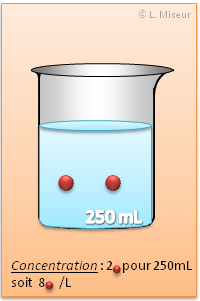
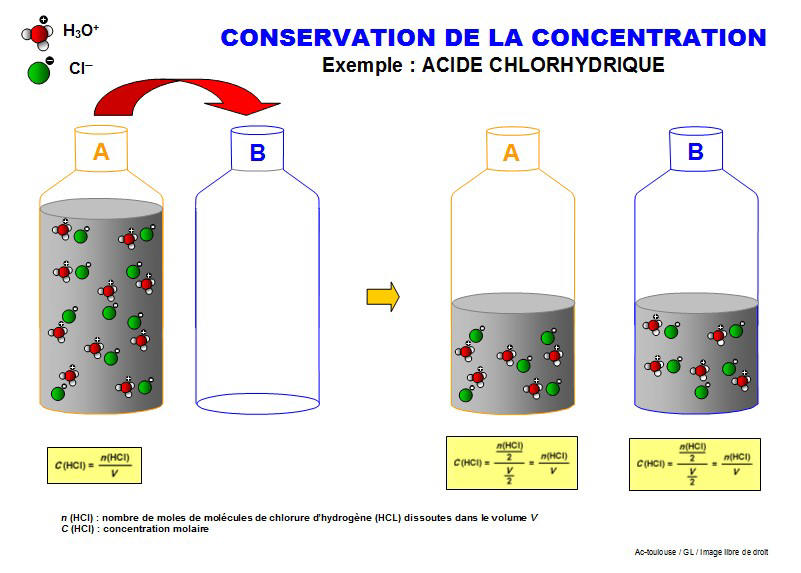
II. Influence du volume sur la concentration molaire
II.1. Variation de la concentration
II.2. Théorie
La concentration molaire est toujours exprimée pour 1 Litre de solution ! (mol/L). Dès lors, si je prends un échantillon de 10 mL d'une solution 3,5 mol/L, la concentration de cet échantillon sera toujours 3,5 mol/L !
III. Autres expressions de la concentration
Il existe plusieurs autres expressions de la concentration :
III.1. La concentration massique
Cette concentration prend en compte le rapport de la masse de soluté et le volume total de la solution.
, l'unité de concentration massique est le g/L (gramme par litre)
III.2. Le % en masse
III.3. La molalité
Nombre de moles de soluté / masse de solution ( unité : mol.kg-1)

III.4. Titre en volume ou fraction volumique >
Volume de soluté / volume total de la solution
ex: 9 ml d'HCl pour 100ml d'H2O
III.5. Titre en masse ou fraction massique
Masse de soluté / masse total de la solution
ex: 9 g d'HCl pour 100g de solution d'HCl+H2O
III.6. Titre en moles ou fraction molaire
Nombre de mole de soluté / nombre de moles total
ex: 9 moles d'HCl pour 100 moles de solution d'HCl.
IV.Exercices
![]()
|
|
|
| |||||||||
|
Copyright (c) 2000 - 2023 | Miseur Ludovic | www.lachimie.net | tous droits réservés | remis à jour le : 06/07/2023 |
|
|
|
Comment citer cette page : |
| Miseur, L. (2023). Lachimie.net - Concentration d'une solution (C). La Chimie.net. http://www.lachimie.net | |
|
|