Stabilité atomique
I. Rayon atomique
I.1. Définition :
Les nuages électroniques contenant les électrons n'ont pas de limites précises, mais lorsque les atomes sont rapprochés les uns contre les autres dans des solides ou dans des molécules, le centre de ces deux atomes sont séparés par une distance bien définie. Il s'agit du rayon atomique. Ce rayon est la distance qui sépare les centres de deux atomes contigus. Cette distance vaut donc 2r.
Variation du rayon atomique :
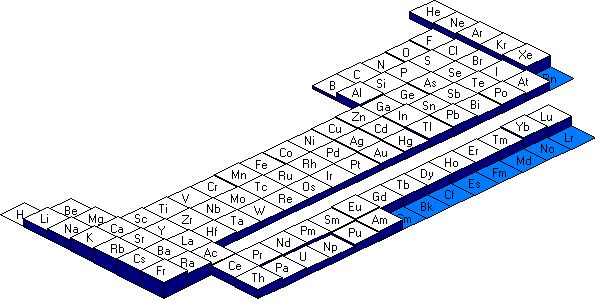
Nous pouvons constater que dans une même période, le rayon diminue de gauche à droite et dans une même famille le rayon augmente de haut en bas.
II. énergie d'ionisation
II.1. Définition
C'est la quantité d'énergie nécessaire pour enlever un ou plusieurs électrons à un atome. Cette énergie à fournir n'est pas identique pour chaque élément et augmente lorsque l'on enlève plusieurs électrons. L'énergie d'ionisation nécessaire à l'arrachement d'un premier électron sera plus petite que celle à fournir pour enlever le deuxième électron et ainsi de suite.
II.2. Graphique montrant les variations de l'énergie d'ionisation selon les éléments :
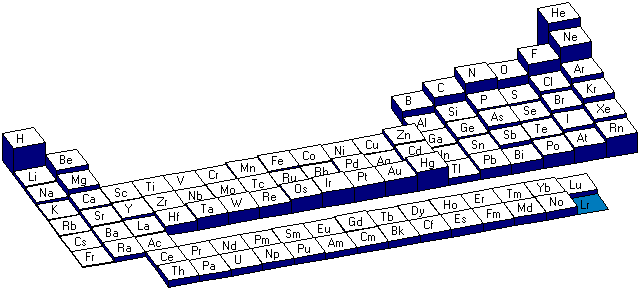
L'analyse des deux graphiques nous démontre que l'énergie de première ionisation (Ei1) diminue lorsque le rayon atomique augmente. Cette variation est due au fait qu'un électron plus proche du noyau subit plus la force d'attraction de celui-ci. Plus le rayon atomique est petit, plus il faudra apporter de l'énergie pour arracher un électron à l'atome.
III. Règle de l'octet
Les deux graphiques qui suivent nous montrent qu'il est possible de poursuivre l'ionisation des atomes afin d'un retirer des électrons. L' énergie fournie pour la deuxième ionisation (enlèvement d'un deuxième électron) sera appelée énergie de deuxième ionisation, pour enlever le troisième électron, il y aura également besoin d'un apport énergétique appelé énergie de troisième ionisation, ...
| soit : | |
| Atome + Ei1 ---> A+ + 1e- | |
| A+ + Ei2 ---> A++ + 1e- | |
| A++ + Ei3 ---> A+++ + 1e- | , ... |
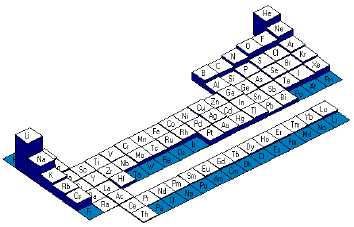 graphique des énergies de
deuxième ionisation (Ei2)
graphique des énergies de
deuxième ionisation (Ei2)
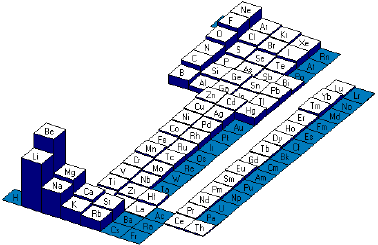 graphique des énergies de
troisième ionisation (Ei3)
graphique des énergies de
troisième ionisation (Ei3)
Nous constatons que des hausses brutales apparaissent dans ces graphes. Ce phénomène est dû au fait que lorsqu'un atome arrive à la même configuration électronique qu'un gaz rare (8 électrons dans sur la couche électronique extérieure), L'atome est plus stable. Cette règle est appelée règle de l'octet.
IV. Affinité électronique
L'affinité électronique, notée Ee, désigne la quantité d'énergie libérée lorsqu'un atome neutre (électriquement) capte un électron pour se transformer en ion négatif.
Par définition : X(g) + 1e- → X-(g)
Les halogènes ont la plus grande affinité électronique. Ces éléments qui possèdent 7 électrons sur leur couche externe, et dont la seule addition d'un électron leur permet d'atteindre la configuration d'un gaz rare ont tendance à "prendre" un électron à un autre atome. A l'inverse, Les métaux ne possède que 2 ou 3 électrons sur leur couche externe et ont plutôt tendance à céder leurs électrons à des éléments plus électronégatifs.
Retenons la règle de l'octet : Un atome possédant 8 électrons dans sa couche électronique externe est plus stable qu'un autre.
|
|
 |
|
Copyright (c) 2000 - 2023 | Miseur Ludovic | www.lachimie.net | tous droits réservés | remis à jour le : 06/07/2023 |
|
|
|
Comment citer cette page : |
| Miseur, L. (2023). Lachimie.net - Stabilité atomique. La Chimie.net. http://www.lachimie.net | |
|
|


